Anoda dan katoda adalah dua komponen penting dalam berbagai perangkat elektronik dan sistem elektrokimia, termasuk baterai, sel elektrolisis, dan tabung vakum. Meskipun keduanya berfungsi dalam konteks yang sama, mereka memiliki perbedaan mendasar dalam hal fungsi, polaritas, dan aplikasi. Dalam artikel ini, kita akan membahas secara mendetail tentang perbedaan antara anoda dan katoda, termasuk definisi, karakteristik, dan contoh penggunaannya dalam berbagai konteks.
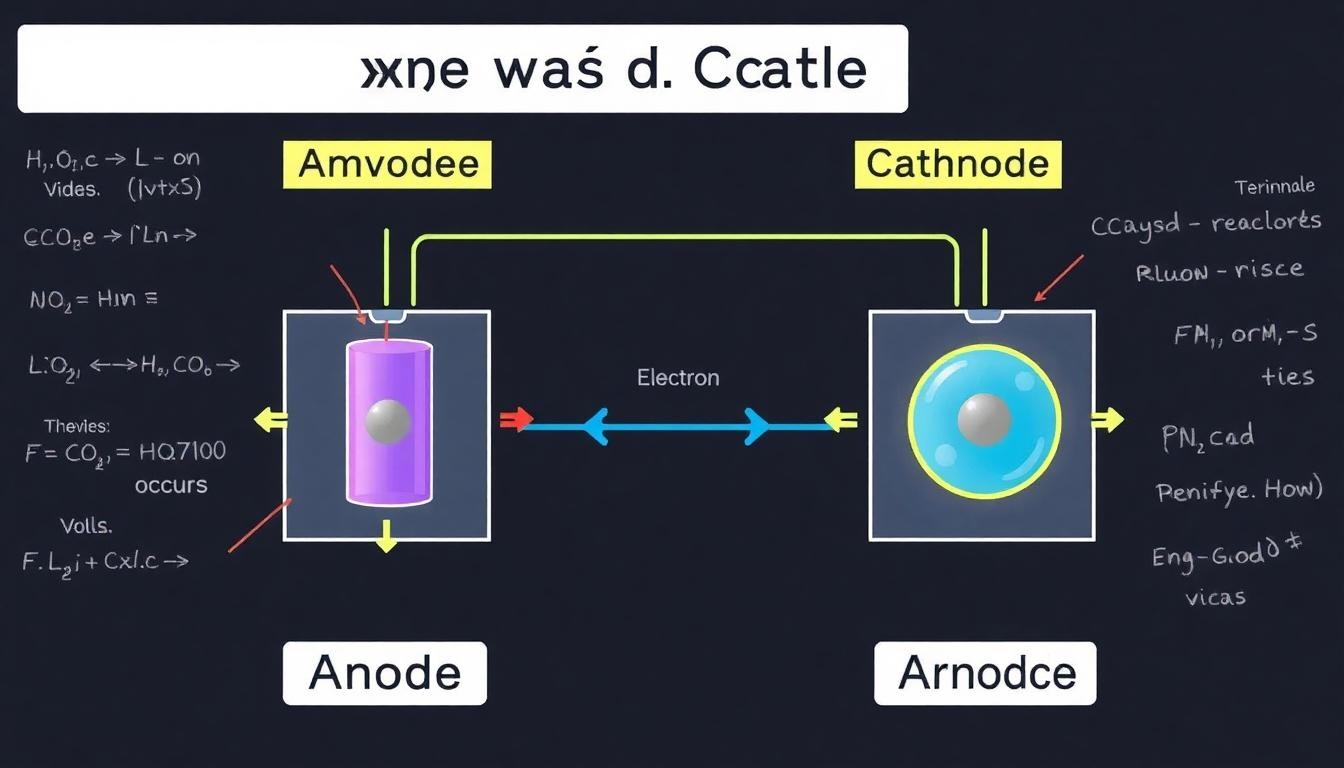
1. Definisi Anoda dan Katoda
a. Anoda
Anoda adalah elektroda di mana oksidasi terjadi dalam suatu reaksi elektrokimia. Dalam konteks baterai atau sel galvanik, anoda adalah elektroda negatif saat perangkat sedang beroperasi. Anoda berfungsi sebagai sumber elektron, yang kemudian mengalir ke katoda melalui rangkaian eksternal. Dalam proses ini, ion positif di dalam larutan atau elektrolit bergerak menuju anoda untuk mendapatkan elektron.
b. Katoda
Katoda adalah elektroda di mana reduksi terjadi dalam suatu reaksi elektrokimia. Dalam baterai atau sel galvanik, katoda adalah elektroda positif saat perangkat sedang beroperasi. Katoda menerima elektron dari anoda melalui rangkaian eksternal. Dalam proses ini, ion positif dari larutan atau elektrolit bergerak menuju katoda untuk menerima elektron dan membentuk spesies yang lebih stabil.
2. Polaritas
Polaritas anoda dan katoda tergantung pada jenis perangkat yang sedang digunakan:
a. Dalam Baterai (Sel Galvanik)
- Anoda: Dalam baterai yang sedang digunakan, anoda adalah elektroda negatif. Ini karena anoda melepaskan elektron ke rangkaian eksternal, yang kemudian mengalir menuju katoda.
- Katoda: Dalam baterai yang sedang digunakan, katoda adalah elektroda positif. Katoda menerima elektron dari rangkaian eksternal dan terlibat dalam reaksi reduksi.
b. Dalam Sel Elektrolisis
- Anoda: Dalam sel elektrolisis, anoda adalah elektroda positif. Ini karena anoda menarik ion negatif (anion) dari larutan untuk melakukan reaksi oksidasi.
- Katoda: Dalam sel elektrolisis, katoda adalah elektroda negatif. Katoda menarik ion positif (kation) dari larutan untuk melakukan reaksi reduksi.
3. Proses Reaksi
a. Reaksi di Anoda
- Oksidasi: Proses yang terjadi di anoda adalah oksidasi, di mana suatu zat kehilangan elektron. Sebagai contoh, dalam baterai zinc-karbon, reaksi di anoda dapat dituliskan sebagai berikut:
![]()
Di sini, seng (Zn) teroksidasi menjadi ion seng (Zn²⁺) dan melepaskan dua elektron.
b. Reaksi di Katoda
- Reduksi: Proses yang terjadi di katoda adalah reduksi, di mana suatu zat menerima elektron. Menggunakan contoh yang sama, reaksi di katoda dalam baterai zinc-karbon dapat dituliskan sebagai berikut:
![]()
Di sini, ion hidrogen (H⁺) menerima dua elektron untuk membentuk gas hidrogen (H₂).
4. Aplikasi Anoda dan Katoda
a. Baterai dan Sel Galvanik
Dalam baterai, anoda dan katoda berfungsi untuk menyimpan dan melepaskan energi listrik. Baterai yang umum digunakan, seperti baterai AA, memiliki anoda yang terbuat dari seng dan katoda yang terbuat dari karbon. Proses kimia yang terjadi di dalam baterai ini memungkinkan konversi energi kimia menjadi energi listrik.
b. Sel Elektrolisis
Dalam sel elektrolisis, anoda dan katoda digunakan untuk memisahkan zat-zat kimia. Contohnya, dalam proses elektrolisis air, anoda menarik ion hidroksida (OH⁻) dan menghasilkan oksigen, sementara katoda menarik ion hidrogen (H⁺) dan menghasilkan gas hidrogen.
c. Tabung Vakum dan Perangkat Elektronik
Dalam tabung vakum, anoda dan katoda digunakan untuk mengontrol aliran elektron. Katoda memancarkan elektron ketika dipanaskan, dan elektron ini kemudian ditarik menuju anoda yang memiliki potensi positif. Proses ini digunakan dalam berbagai aplikasi, termasuk televisi tabung dan radio.
Berikut adalah tabel yang merinci perbedaan antara anoda dan katoda, dua elektroda yang memiliki peran penting dalam berbagai proses elektrokimia, termasuk dalam sel galvanik, sel elektrolitik, dan perangkat elektronik. Tabel ini mencakup definisi, fungsi, reaksi yang terjadi, jenis, serta contoh dari masing-masing elektroda. Dengan penjelasan yang mendalam, diharapkan pembaca dapat memahami perbedaan mendasar antara anoda dan katoda.
| Aspek | Anoda | Katoda |
| Definisi | Anoda adalah elektroda di mana oksidasi terjadi, yaitu proses di mana ion atau atom kehilangan elektron. | Katoda adalah elektroda di mana reduksi terjadi, yaitu proses di mana ion atau atom mendapatkan elektron. |
| Fungsi | – Tempat terjadinya reaksi oksidasi. – Menghasilkan ion positif yang bergerak menuju katoda. |
– Tempat terjadinya reaksi reduksi. – Menerima ion positif yang bergerak dari anoda. |
| Reaksi yang Terjadi | – Reaksi oksidasi, di mana zat kehilangan elektron. – Contoh: Zn → Zn²⁺ + 2e⁻ (zinc teroksidasi). |
– Reaksi reduksi, di mana zat mendapatkan elektron. – Contoh: Cu²⁺ + 2e⁻ → Cu (tembaga tereduksi). |
| Tanda | – Dalam sel galvanik, anoda memiliki tanda negatif (-). – Dalam sel elektrolitik, anoda memiliki tanda positif (+). |
– Dalam sel galvanik, katoda memiliki tanda positif (+). – Dalam sel elektrolitik, katoda memiliki tanda negatif (-). |
| Jenis | – Dapat berupa logam, karbon, atau bahan lain yang dapat mengoksidasi. – Contoh: anoda seng dalam sel galvanik. |
– Dapat berupa logam, karbon, atau bahan lain yang dapat mereduksi. – Contoh: katoda tembaga dalam sel galvanik. |
| Contoh dalam Sel Galvanik | – Anoda adalah tempat reaksi oksidasi, seperti seng (Zn) yang teroksidasi menjadi ion seng. | – Katoda adalah tempat reaksi reduksi, seperti tembaga (Cu²⁺) yang tereduksi menjadi tembaga logam. |
| Contoh dalam Sel Elektrolitik | – Anoda adalah elektroda positif, di mana oksidasi terjadi, seperti pada proses elektrolisis air. | – Katoda adalah elektroda negatif, di mana reduksi terjadi, seperti pada proses elektrolisis air. |
| Peran dalam Proses Elektrokimia | – Anoda berperan dalam menghasilkan ion positif yang diperlukan untuk reaksi elektrokimia. – Memfasilitasi aliran arus listrik dengan melepaskan elektron. |
– Katoda berperan dalam menerima ion positif dan menyelesaikan siklus reaksi elektrokimia. – Memfasilitasi aliran arus listrik dengan menerima elektron. |
Penjelasan Tambahan
- Definisi: Anoda adalah elektroda tempat terjadinya oksidasi, sedangkan katoda adalah elektroda tempat terjadinya reduksi.
- Fungsi: Anoda berfungsi sebagai sumber ion positif, sedangkan katoda berfungsi sebagai penerima ion positif.
- Reaksi yang Terjadi: Anoda mengalami reaksi oksidasi, sedangkan katoda mengalami reaksi reduksi.
- Tanda: Anoda memiliki tanda negatif dalam sel galvanik dan positif dalam sel elektrolitik, sedangkan katoda memiliki tanda positif dalam sel galvanik dan negatif dalam sel elektrolitik.
- Jenis: Anoda dapat terbuat dari berbagai bahan, termasuk logam dan karbon, sedangkan katoda juga dapat terbuat dari bahan yang sama.
- Contoh dalam Sel Galvanik: Anoda dan katoda dalam sel galvanik berfungsi untuk menghasilkan arus listrik melalui reaksi redoks.
- Contoh dalam Sel Elektrolitik: Anoda dan katoda dalam sel elektrolitik berfungsi untuk memfasilitasi proses elektrolisis.
- Peran dalam Proses Elektrokimia: Anoda dan katoda memiliki peran penting dalam menghasilkan dan menerima arus listrik, yang merupakan dasar dari banyak aplikasi elektrokimia.
Dengan tabel dan penjelasan di atas, diharapkan pembaca dapat memahami perbedaan yang signifikan antara anoda dan katoda, serta bagaimana kedua elektroda ini berperan dalam proses elektrokimia dan aplikasi praktis.
5. Kesimpulan
Anoda dan katoda adalah dua komponen kunci dalam berbagai sistem elektrokimia dan perangkat elektronik. Meskipun keduanya berfungsi dalam konteks yang sama, mereka memiliki perbedaan mendasar dalam hal polaritas, proses reaksi, dan aplikasi. Anoda adalah elektroda di mana oksidasi terjadi dan biasanya berfungsi sebagai sumber elektron, sedangkan katoda adalah elektroda di mana reduksi terjadi dan menerima elektron. Memahami perbedaan ini sangat penting dalam bidang kimia, fisika, dan teknik, serta dalam pengembangan teknologi yang bergantung pada reaksi elektrokimia. Dengan pengetahuan ini, kita dapat lebih memahami cara kerja berbagai perangkat yang kita gunakan sehari-hari dan bagaimana energi dapat dikonversi dari satu bentuk ke bentuk lainnya.
