Afinitas elektron adalah salah satu konsep penting dalam kimia yang menggambarkan bagaimana atom berinteraksi dengan elektron. Pemahaman terhadap afinitas elektron memberikan wawasan mendalam tentang sifat atom, khususnya dalam kaitannya dengan pembentukan ion dan reaktivitas kimia. Dalam artikel ini, kita akan menjelaskan pengertian afinitas elektron, faktor-faktor yang memengaruhinya, serta contohnya dalam kehidupan nyata untuk mempermudah pemahaman.
—
Pengertian Afinitas Elektron
Afinitas elektron adalah jumlah energi yang dilepaskan (atau diserap) ketika sebuah atom netral dalam fase gas menangkap satu elektron untuk membentuk ion bermuatan negatif. Dalam proses ini, atom mengalami perubahan energi, yang menjadi ukuran dari seberapa besar atom tersebut “menginginkan” elektron tambahan.
Jika suatu atom memiliki afinitas elektron yang tinggi, itu berarti atom tersebut sangat cenderung untuk menangkap elektron. Sebaliknya, jika afinitas elektronnya rendah atau bahkan positif, atom tersebut tidak begitu tertarik untuk menangkap elektron.
Ilustrasi Konsep:
Bayangkan atom seperti magnet yang menarik partikel kecil (elektron). Magnet yang kuat (atom dengan afinitas elektron tinggi) akan dengan mudah menarik partikel tersebut, sementara magnet yang lemah (atom dengan afinitas elektron rendah) tidak mampu melakukannya.
—
Satuan dan Penulisan Afinitas Elektron
Afinitas elektron biasanya diukur dalam satuan kilojoule per mol (kJ/mol) atau elektronvolt (eV). Nilainya bisa negatif atau positif:
- Nilai negatif menunjukkan energi dilepaskan ketika atom menangkap elektron (proses eksotermik).
- Nilai positif menunjukkan energi harus diberikan agar atom menangkap elektron (proses endotermik).
Sebagai contoh:
- Afinitas elektron klorin:
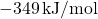 (energi dilepaskan).
(energi dilepaskan). - Afinitas elektron neon:
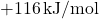 (energi diserap).
(energi diserap).
—
Mekanisme Afinitas Elektron
Ketika sebuah atom menangkap elektron, elektron yang masuk akan ditarik oleh gaya tarik elektrostatik dari inti atom. Energi yang dilepaskan selama proses ini disebut afinitas elektron. Namun, jika atom sudah memiliki konfigurasi elektron yang stabil, seperti gas mulia, penambahan elektron justru membutuhkan energi karena gaya tolak antar elektron di kulit terluar.
Ilustrasi Mekanisme:
Bayangkan sebuah kursi penuh dengan orang duduk (elektron). Jika ada orang baru yang ingin duduk, ia harus menemukan ruang di kursi yang sudah padat. Jika kursi itu lapang (seperti atom klorin), ia dapat duduk dengan mudah dan suasana menjadi nyaman (energi dilepaskan). Tetapi jika kursi itu penuh (seperti gas mulia), memaksakan tempat duduk membutuhkan usaha (energi diserap).
—
Faktor-Faktor yang Mempengaruhi Afinitas Elektron
1. Konfigurasi Elektron
Atom dengan konfigurasi elektron yang hampir stabil, seperti halogen, memiliki afinitas elektron tinggi karena tambahan elektron akan melengkapi kulit terluarnya. Sebaliknya, atom dengan kulit yang sudah penuh, seperti gas mulia, memiliki afinitas elektron rendah atau bahkan positif.
– Contoh: Klorin (![]() ) memiliki afinitas elektron yang tinggi (
) memiliki afinitas elektron yang tinggi (![]() ) karena dengan menangkap satu elektron, ia mencapai konfigurasi stabil seperti argon.
) karena dengan menangkap satu elektron, ia mencapai konfigurasi stabil seperti argon.
2. Jarak Elektron dari Inti Atom
Atom yang lebih kecil memiliki afinitas elektron lebih tinggi karena elektron yang ditangkap berada lebih dekat dengan inti, sehingga gaya tariknya lebih besar. Sebaliknya, atom yang lebih besar memiliki afinitas elektron lebih rendah.
– Contoh: Fluorin (![]() ) memiliki afinitas elektron lebih tinggi dibandingkan bromin (
) memiliki afinitas elektron lebih tinggi dibandingkan bromin (![]() ), karena ukuran atom fluorin lebih kecil.
), karena ukuran atom fluorin lebih kecil.
3. Gaya Tolak Elektron-Elektron
Jika elektron baru harus masuk ke kulit yang sudah padat, gaya tolak antar elektron akan mengurangi afinitas elektron.
– Contoh: Oksigen (![]() ) memiliki afinitas elektron lebih rendah dibandingkan fluorin (
) memiliki afinitas elektron lebih rendah dibandingkan fluorin (![]() ) karena elektron tambahan pada oksigen harus berbagi ruang di orbital yang sudah padat.
) karena elektron tambahan pada oksigen harus berbagi ruang di orbital yang sudah padat.
—
Contoh Afinitas Elektron dalam Tabel Periodik
1. Afinitas Elektron Tinggi: Halogen
Halogen, seperti fluor (![]() ), klorin (
), klorin (![]() ), dan bromin (
), dan bromin (![]() ), memiliki afinitas elektron tinggi karena mereka hanya membutuhkan satu elektron untuk mencapai konfigurasi elektron stabil.
), memiliki afinitas elektron tinggi karena mereka hanya membutuhkan satu elektron untuk mencapai konfigurasi elektron stabil.
– Contoh: Afinitas elektron klorin adalah salah satu yang tertinggi di tabel periodik, sebesar ![]() .
.
2. Afinitas Elektron Rendah: Gas Mulia
Gas mulia seperti helium (![]() ), neon (
), neon (![]() ), dan argon (
), dan argon (![]() ) memiliki afinitas elektron yang sangat rendah atau bahkan positif. Ini karena mereka sudah memiliki kulit elektron terluar yang penuh, sehingga penambahan elektron baru tidak menguntungkan secara energi.
) memiliki afinitas elektron yang sangat rendah atau bahkan positif. Ini karena mereka sudah memiliki kulit elektron terluar yang penuh, sehingga penambahan elektron baru tidak menguntungkan secara energi.
– Contoh: Neon (![]() ) memiliki afinitas elektron
) memiliki afinitas elektron ![]() , yang berarti energi harus diberikan agar atom neon menangkap elektron.
, yang berarti energi harus diberikan agar atom neon menangkap elektron.
3. Variasi dalam Golongan
Dalam satu golongan, afinitas elektron cenderung menurun dari atas ke bawah karena ukuran atom bertambah, sehingga gaya tarik inti terhadap elektron tambahan menjadi lebih lemah.
– Contoh: Fluorin (![]() ) memiliki afinitas elektron lebih tinggi dibandingkan iodin (
) memiliki afinitas elektron lebih tinggi dibandingkan iodin (![]() ).
).
—
Contoh Penerapan Afinitas Elektron
1. Reaksi Kimia
Dalam reaksi kimia, afinitas elektron menentukan seberapa mudah suatu atom menerima elektron untuk membentuk ion negatif.
– Contoh: Dalam pembentukan natrium klorida (![]() ), atom klorin menangkap elektron dari atom natrium, menghasilkan ion klorida (
), atom klorin menangkap elektron dari atom natrium, menghasilkan ion klorida (![]() ).
).
2. Pembuatan Bahan Kimia Industri
Dalam industri, sifat afinitas elektron digunakan untuk memisahkan unsur-unsur tertentu atau menghasilkan senyawa.
– Contoh: Klorin (![]() ) digunakan dalam pembuatan pemutih dan desinfektan karena kemampuannya menerima elektron.
) digunakan dalam pembuatan pemutih dan desinfektan karena kemampuannya menerima elektron.
3. Astrofisika
Afinitas elektron juga relevan dalam pembentukan ion dalam ruang angkasa. Misalnya, ionisasi partikel di atmosfer bintang dipengaruhi oleh sifat afinitas elektron atom-atom yang ada di dalamnya.
Ilustrasi Penerapan:
Bayangkan reaksi kimia sederhana di mana atom klorin dengan afinitas elektron tinggi “merebut” elektron dari atom natrium, membentuk pasangan ion yang stabil. Proses ini adalah dasar dari banyak senyawa ionik yang kita gunakan sehari-hari, seperti garam dapur.
—
Kesimpulan
Afinitas elektron adalah konsep penting dalam memahami bagaimana atom menangkap elektron dan membentuk ion negatif. Konsep ini dipengaruhi oleh berbagai faktor, seperti konfigurasi elektron, ukuran atom, dan gaya tolak antar elektron. Halogen seperti klorin memiliki afinitas elektron tinggi, sementara gas mulia seperti neon memiliki afinitas elektron rendah.
Dengan memahami afinitas elektron, kita dapat menjelaskan sifat reaktif atom dalam tabel periodik dan memahami banyak fenomena kimia di sekitar kita. Konsep ini menjadi landasan penting dalam ilmu kimia, memungkinkan kita untuk memahami bagaimana unsur-unsur berinteraksi dan membentuk dunia seperti yang kita kenal.
