Tabel periodik unsur adalah salah satu alat paling penting dalam dunia kimia. Kalau kamu pernah belajar kimia, pasti kamu nggak asing lagi dengan tabel yang penuh dengan simbol-simbol unsur itu. Tapi, tahukah kamu bahwa tabel periodik yang kita pakai sekarang itu nggak muncul begitu aja? Ada sejarah panjang di balik pembuatannya, dengan kontribusi dari berbagai ilmuwan besar, dan dua nama yang sering disebut adalah Dmitri Mendeleev dan Henry Moseley.
Nah, dalam artikel ini, kita bakal bahas perbedaan tabel periodik Mendeleev dan Moseley, siapa mereka, apa yang bikin ide-ide mereka beda, dan gimana kontribusi mereka akhirnya bikin kita bisa menikmati tabel periodik modern yang kita kenal sekarang.
1. Mendeleev: Si Perintis Tabel Periodik
Dmitri Mendeleev adalah ilmuwan asal Rusia yang terkenal sebagai “bapaknya” tabel periodik. Sekitar tahun 1869, Mendeleev memperkenalkan konsep tabel periodik yang cukup revolusioner untuk zamannya. Saat itu, para ilmuwan sudah menemukan banyak unsur, tapi belum ada cara yang jelas untuk mengelompokkannya. Mereka tahu beberapa unsur punya sifat yang mirip, tapi bagaimana semua unsur itu bisa dipetakan dengan logis? Nah, Mendeleev lah yang pertama kali menemukan pola tersebut.
a. Cara Mendeleev Menyusun Tabel
Mendeleev menyusun unsur-unsur berdasarkan massa atom relatif mereka. Jadi, unsur-unsur disusun dalam urutan meningkat berdasarkan massa atom, dari yang paling ringan hingga yang paling berat. Ketika dia menyusun unsur-unsur ini, dia juga memperhatikan sifat-sifat kimia dan fisika mereka. Misalnya, unsur-unsur dengan sifat yang mirip ditempatkan dalam kolom yang sama (yang nantinya dikenal sebagai “golongan” dalam tabel periodik).
Uniknya, Mendeleev melakukan sesuatu yang belum pernah dilakukan sebelumnya. Dia berani membuat celah di tabelnya dan memprediksi bahwa ada unsur-unsur yang belum ditemukan. Dia yakin bahwa celah-celah ini akan diisi oleh unsur-unsur baru dengan massa atom dan sifat-sifat tertentu yang cocok dengan pola yang sudah dia temukan. Beberapa prediksinya ini ternyata benar! Ketika unsur-unsur seperti germanium, gallium, dan scandium ditemukan, sifat-sifat mereka hampir persis seperti yang diramalkan Mendeleev.
b. Kelemahan Tabel Mendeleev
Meski tabel Mendeleev revolusioner, tabel ini punya kelemahan. Karena dia menyusun unsur berdasarkan massa atom, ada beberapa anomali yang nggak bisa dijelaskan. Misalnya, ada beberapa unsur yang nggak cocok ditempatkan bersama unsur dengan sifat serupa jika hanya berdasarkan massa atomnya. Salah satu contohnya adalah pasangan unsur iodin (I) dan tellurium (Te). Iodin memiliki massa atom yang lebih ringan, tapi sifat kimianya lebih mirip dengan unsur-unsur di kelompok tellurium. Jadi, menurut sifatnya, iodin seharusnya ditempatkan setelah tellurium, meskipun massanya lebih kecil.
2. Moseley: Menyempurnakan Tabel Periodik
Sekarang, masuklah Henry Moseley. Dia adalah fisikawan muda asal Inggris yang, pada awal abad ke-20, berhasil menyempurnakan tabel periodik dengan pemahaman yang lebih dalam tentang struktur atom. Moseley melakukan eksperimen spektroskopi dan menemukan bahwa unsur-unsur nggak seharusnya disusun berdasarkan massa atom seperti yang dilakukan Mendeleev, melainkan berdasarkan nomor atom, atau jumlah proton dalam inti atomnya.
a. Penemuan Moseley tentang Nomor Atom
Penemuan Moseley ini adalah titik balik besar dalam sejarah tabel periodik. Dia menemukan bahwa sifat-sifat kimia unsur-unsur lebih erat kaitannya dengan nomor atom mereka daripada massa atom. Nomor atom menunjukkan jumlah proton dalam inti atom, yang merupakan karakteristik paling mendasar dari setiap unsur. Dengan menggunakan nomor atom untuk menyusun tabel periodik, banyak anomali yang ada di tabel Mendeleev bisa diperbaiki.
Misalnya, ingat soal iodin dan tellurium tadi? Ketika tabel disusun berdasarkan nomor atom, masalah itu langsung terselesaikan. Iodin punya nomor atom 53, dan tellurium punya nomor atom 52. Jadi, iodin memang seharusnya ditempatkan setelah tellurium di tabel, sesuai dengan urutan nomor atom mereka, bukan berdasarkan massa atom. Dan saat disusun dengan cara ini, unsur-unsur dengan sifat yang mirip juga secara alami jatuh dalam kolom yang sama.
b. Dampak Penemuan Moseley
Setelah Moseley mengusulkan penyusunan tabel berdasarkan nomor atom, banyak hal yang jadi lebih masuk akal di dunia kimia. Ini juga membantu para ilmuwan mengidentifikasi unsur-unsur yang belum ditemukan, karena nomor atom memberi petunjuk yang jelas tentang posisi yang hilang di tabel. Misalnya, mereka tahu bahwa ada nomor atom 43 yang hilang, dan itu akhirnya ditemukan sebagai unsur teknesium (Tc), unsur buatan yang nggak ditemukan secara alami di bumi.
Moseley meninggal pada usia muda karena ikut dalam Perang Dunia I, tapi penemuannya sangat penting dan telah mengubah cara kita memahami tabel periodik untuk selamanya.
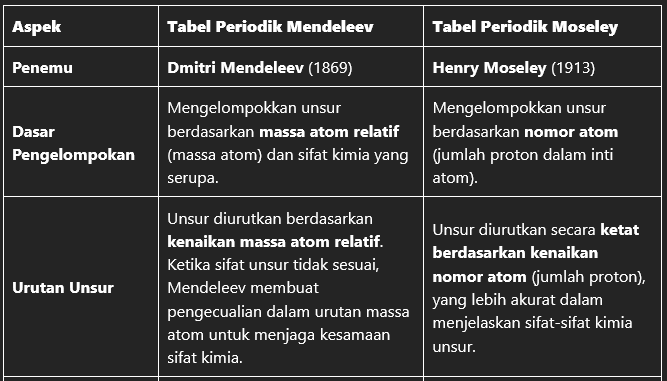
3. Perbedaan Utama antara Tabel Mendeleev dan Tabel Moseley
Berikut adalah tabel yang menunjukkan perbedaan antara Tabel Periodik Mendeleev dan Tabel Periodik Moseley:
| Aspek | Tabel Periodik Mendeleev | Tabel Periodik Moseley |
|---|---|---|
| Penemu | Dmitri Mendeleev (1869) | Henry Moseley (1913) |
| Dasar Pengelompokan | Mengelompokkan unsur berdasarkan massa atom relatif (massa atom) dan sifat kimia yang serupa. | Mengelompokkan unsur berdasarkan nomor atom (jumlah proton dalam inti atom). |
| Urutan Unsur | Unsur diurutkan berdasarkan kenaikan massa atom relatif. Ketika sifat unsur tidak sesuai, Mendeleev membuat pengecualian dalam urutan massa atom untuk menjaga kesamaan sifat kimia. | Unsur diurutkan secara ketat berdasarkan kenaikan nomor atom (jumlah proton), yang lebih akurat dalam menjelaskan sifat-sifat kimia unsur. |
| Penjelasan Sifat Periode | Mendeleev mengamati bahwa sifat kimia unsur berulang secara periodik berdasarkan massa atom. Ia menggunakan pola ini untuk mengelompokkan unsur dalam tabel. | Moseley menemukan bahwa sifat kimia unsur lebih berkaitan dengan nomor atom daripada massa atom, sehingga ia menyusun ulang tabel berdasarkan nomor atom, yang menjelaskan sifat periodik dengan lebih tepat. |
| Kelemahan Utama | Beberapa unsur tampak tidak berada di tempat yang benar jika hanya berdasarkan massa atom. Misalnya, K (kalium) ditempatkan sebelum Ar (argon) meskipun massa atom kalium lebih besar. | Tidak memiliki kelemahan seperti Tabel Mendeleev karena nomor atom memberikan susunan yang lebih konsisten dengan sifat kimia unsur. |
| Prediksi Unsur yang Hilang | Mendeleev meninggalkan kekosongan dalam tabelnya untuk unsur yang belum ditemukan, dan ia mampu memprediksi sifat-sifat unsur yang belum dikenal dengan akurat, seperti germanium (Ge), yang ia sebut sebagai “eka-silikon“. | Moseley tidak perlu meninggalkan kekosongan dalam tabelnya karena nomor atom sudah diketahui dengan lebih pasti, dan sifat periodik unsur lebih dapat diprediksi berdasarkan urutan nomor atom. |
| Contoh Anomali | Beberapa unsur ditempatkan berdasarkan kesamaan sifat kimia meskipun massa atom mereka tidak sesuai dengan urutan. Misalnya, tellurium (Te) ditempatkan sebelum iodin (I) meskipun massa atom Te lebih besar. | Tidak ada anomali seperti pada tabel Mendeleev karena tabel Moseley diurutkan berdasarkan nomor atom, yang mencerminkan susunan yang lebih tepat dan konsisten dengan sifat kimia. |
| Penemuan dan Justifikasi | Mendeleev tidak mengetahui tentang proton atau nomor atom, sehingga ia hanya bisa menggunakan massa atom untuk menyusun unsur. Penemuan proton oleh Rutherford pada tahun 1911 baru memberikan dasar bagi Moseley untuk menyusun tabel berdasarkan nomor atom. | Moseley menggunakan spektrum sinar-X untuk menentukan nomor atom unsur secara akurat, dan ini menjelaskan mengapa pengelompokan berdasarkan nomor atom lebih logis daripada massa atom. |
| Kekosongan dalam Tabel | Mendeleev dengan sengaja meninggalkan beberapa kekosongan dalam tabelnya untuk unsur yang belum ditemukan. Misalnya, ia memprediksi adanya unsur seperti eka-aluminium yang kemudian ditemukan sebagai gallium (Ga). | Berkat pengetahuan tentang nomor atom, tabel Moseley tidak memerlukan kekosongan. Semua unsur yang telah ditemukan hingga saat itu memiliki tempat yang jelas dalam tabel. |
| Periode dan Golongan | Tabel Mendeleev memiliki periode yang kurang teratur dibandingkan tabel modern. Beberapa unsur ditempatkan dalam golongan sesuai dengan sifat kimia, tetapi urutannya tidak selalu konsisten dengan kenaikan massa atom. | Tabel Moseley lebih teratur dalam pengelompokan unsur ke dalam periode dan golongan berdasarkan nomor atom, yang lebih sesuai dengan sifat periodik unsur dalam tabel modern. |
| Pengaruh pada Tabel Periodik Modern | Tabel Mendeleev merupakan dasar bagi pengembangan tabel periodik, tetapi revisi besar diperlukan setelah penemuan nomor atom. | Tabel Moseley menjadi dasar bagi tabel periodik modern, karena pengelompokan berdasarkan nomor atom memberikan penggambaran yang lebih akurat tentang sifat-sifat unsur. |
| Penemuan Spektrum Sinar-X | Tidak terlibat dalam penemuan spektrum sinar-X atau penggunaan nomor atom dalam pengelompokan unsur. | Moseley menggunakan spektrum sinar-X untuk mengidentifikasi jumlah proton dalam inti atom dan mengatur unsur berdasarkan nomor atom, yang menyelesaikan banyak anomali dalam tabel Mendeleev. |
| Contoh Unsur dalam Tabel | Dalam tabel Mendeleev, unsur seperti tellurium (Te) ditempatkan sebelum iodin (I) meskipun massa atom Te lebih besar, karena kesamaan sifat kimia. | Dalam tabel Moseley, unsur diurutkan berdasarkan nomor atom sehingga iodin (I) ditempatkan setelah tellurium (Te) sesuai dengan nomor atomnya (Te = 52, I = 53). |
| Jumlah Unsur saat Itu | Saat Mendeleev menyusun tabelnya, hanya ada 63 unsur yang diketahui. | Ketika Moseley menyusun tabelnya, lebih banyak unsur telah ditemukan, dan ia mampu mengatur sekitar 80 unsur yang diketahui pada saat itu. |
| Penyempurnaan dalam Menemukan Unsur Baru | Mendeleev berhasil memprediksi unsur baru dan sifat-sifatnya dengan akurasi tinggi meskipun hanya berdasarkan massa atom dan pola sifat kimia. | Moseley tidak secara langsung memprediksi unsur baru, tetapi tabel periodiknya berdasarkan nomor atom memberikan kerangka yang jelas untuk menemukan unsur baru di tempat yang kosong. |
Penjelasan Tambahan:
- Tabel Periodik Mendeleev (1869): Mendeleev mengelompokkan unsur-unsur berdasarkan massa atom relatif dan sifat kimia, serta meninggalkan kekosongan untuk unsur yang belum ditemukan. Meskipun Mendeleev tidak mengetahui tentang proton atau nomor atom, ia berhasil memprediksi unsur baru dengan cukup akurat.
- Tabel Periodik Moseley (1913): Moseley memperbaiki tabel periodik Mendeleev dengan mengelompokkan unsur berdasarkan nomor atom (jumlah proton), yang memberikan pengelompokan yang lebih akurat dan menyelesaikan anomali dalam tabel Mendeleev. Moseley menggunakan spektrum sinar-X untuk menentukan nomor atom unsur secara akurat, dan tabelnya menjadi dasar bagi tabel periodik modern.
Tabel ini memperlihatkan bahwa Tabel Mendeleev disusun berdasarkan massa atom, sementara Tabel Moseley disusun berdasarkan nomor atom, yang memberikan susunan yang lebih akurat dan konsisten dengan sifat kimia unsur.
Nah, sekarang kita udah tahu dasar-dasar dari kedua tokoh ini, mari kita bedah perbedaan antara tabel versi Mendeleev dan Moseley.
a. Kriteria Penyusunan Tabel
- Mendeleev: Menyusun unsur berdasarkan massa atom relatif. Dia percaya bahwa urutan massa atom adalah cara terbaik untuk mengelompokkan unsur.
- Moseley: Menyusun unsur berdasarkan nomor atom atau jumlah proton dalam inti atom. Ini adalah pendekatan yang lebih mendasar dan akurat karena sifat unsur-unsur lebih terkait dengan nomor atom daripada massa.
b. Keberadaan Anomali
- Tabel Mendeleev: Ada beberapa anomali dalam tabel Mendeleev, di mana beberapa unsur tampaknya “salah tempat” jika disusun berdasarkan massa atom. Contohnya, iodin dan tellurium, serta beberapa pasangan lainnya.
- Tabel Moseley: Setelah Moseley menyusun tabel berdasarkan nomor atom, anomali-anomali ini bisa diselesaikan. Penyusunan berdasarkan nomor atom membuat semua unsur berada di tempat yang tepat sesuai dengan sifat kimianya.
c. Prediksi Unsur Baru
- Mendeleev: Salah satu kekuatan utama Mendeleev adalah kemampuannya memprediksi unsur-unsur yang belum ditemukan. Dia dengan cerdas meninggalkan celah dalam tabelnya dan memprediksi sifat-sifat unsur yang akan mengisi celah-celah tersebut. Banyak prediksinya terbukti akurat ketika unsur-unsur baru ditemukan.
- Moseley: Moseley juga membantu memperkirakan unsur-unsur yang belum ditemukan, tapi pendekatannya lebih berbasis pada nomor atom. Ketika ada “nomor atom yang hilang” dalam tabel, ini menunjukkan bahwa unsur tersebut belum ditemukan.
d. Penjelasan Sifat Unsur
- Mendeleev: Tabel Mendeleev cukup bagus dalam mengelompokkan unsur-unsur dengan sifat kimia yang mirip, tapi ada beberapa pengecualian yang tidak bisa dijelaskan sepenuhnya oleh massa atom.
- Moseley: Dengan tabel Moseley, sifat-sifat unsur lebih konsisten dalam tiap kolom (golongan) karena nomor atom memberikan landasan yang lebih fundamental untuk pengelompokan unsur.
4. Kenapa Penemuan Ini Penting?
Penemuan dan penyempurnaan tabel periodik ini nggak cuma penting buat ahli kimia, tapi juga buat pemahaman kita tentang bagaimana dunia bekerja di tingkat atom. Tabel periodik adalah salah satu alat paling mendasar yang digunakan oleh ilmuwan di seluruh dunia. Dari bidang farmasi, teknologi, hingga kimia material, tabel ini memberikan panduan tentang bagaimana unsur-unsur berinteraksi satu sama lain dan bagaimana kita bisa memanfaatkannya.
Dengan tabel Mendeleev, kita mendapat struktur dasar yang brilian dan memungkinkan ilmuwan untuk mulai mengelompokkan unsur secara sistematis. Dan dengan tabel Moseley, kita mendapat penyempurnaan yang memperbaiki celah-celah dalam pemahaman kita, memastikan bahwa setiap unsur berada di tempat yang tepat.
Kesimpulan
Dmitri Mendeleev dan Henry Moseley, meskipun bekerja pada waktu yang berbeda, masing-masing berkontribusi besar pada pengembangan tabel periodik unsur. Mendeleev adalah perintis yang berani membuat prediksi cerdas tentang unsur-unsur yang belum ditemukan, sementara Moseley, dengan penemuan nomor atom, menyempurnakan tabel dan menyelesaikan anomali yang sebelumnya sulit dijelaskan.
Perbedaan utama mereka adalah cara mereka menyusun unsur: Mendeleev berdasarkan massa atom, dan Moseley berdasarkan nomor atom. Tapi pada akhirnya, kombinasi ide-ide mereka membuat kita punya tabel periodik yang lebih komprehensif dan akurat, yang masih kita gunakan hingga sekarang.
