Reaksi redoks adalah fenomena kimia yang penting dan kompleks, yang melibatkan transfer elektron antara zat-zat kimia. Memahami konsep oksidasi, reduksi, dan bilangan oksidasi dapat membantu kita menjelaskan dan memprediksi reaksi redoks yang terjadi dalam berbagai konteks.
Apa itu reaksi redoks?
Reaksi kimia di mana terjadi pertukaran elektron antara atom atau molekul yang terlibat dikenal sebagai reaksi redoks, reaksi oksidasi-reduksi, atau reaksi reduksi-oksidasi.
Pertukaran ini tercermin dalam perubahan bilangan oksidasi reaktan. Reaktan yang melepaskan elektron mengalami oksidasi dan reaktan yang menerimanya mengalami reduksi.
Bilangan oksidasi menunjukkan jumlah elektron yang dilepaskan atau diterima oleh atom suatu unsur kimia ketika menjadi bagian dari reaksi kimia. Ini juga dapat diartikan sebagai muatan listrik yang dimiliki suatu atom jika semua ikatannya dengan atom lain sepenuhnya bersifat ionik. Ini juga disebut bilangan oksidasi atau valensi.
Bilangan oksidasi dinyatakan dalam bilangan bulat, dengan nol adalah bilangan oksidasi unsur netral. Oleh karena itu, ia dapat mengambil nilai positif atau negatif tergantung pada jenis atom dan reaksi yang diikutinya. Di sisi lain, beberapa atom memiliki bilangan oksidasi yang bervariasi tergantung pada reaksi yang melibatkannya.
Mengetahui cara menentukan bilangan oksidasi atau bilangan oksidasi setiap atom dalam suatu senyawa kimia dengan benar sangat penting untuk dapat memahami dan menganalisis reaksi redoks. Ada aturan tertentu yang memungkinkan Anda menghitung nilainya:
-
- Bilangan oksidasi unsur atau molekul netral adalah nol. Misalnya: logam padat (Fe, Cu, Zn…), molekul (O 2 , N 2 , F 2 ).
- Ion-ion yang tersusun dari satu atom mempunyai bilangan oksidasi yang sama dengan muatannya. Contoh: Na + , Li + , Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , Cl – .
- Fluor selalu memiliki bilangan oksidasi -1 karena merupakan unsur paling elektronegatif yang ada (F – ).
- Hidrogen selalu memiliki bilangan oksidasi +1 (H + ), kecuali hidrida logam (kalium hidrida, KH), yang memiliki bilangan oksidasi -1 (H – ).
- Oksigen memiliki bilangan oksidasi -2, dengan beberapa pengecualian:
- Ketika membentuk senyawa dengan fluor, ia memiliki bilangan oksidasi 2+. Misalnya: oksigen difluorida (OF 2 ).
- Bila membentuk peroksida mempunyai bilangan oksidasi -1 (O 2 2- ). Misalnya: hidrogen peroksida (H 2 O 2 ), natrium peroksida (Na 2 O 2 ).
- Ketika membentuk superoksida, ia memiliki bilangan oksidasi -½ (O 2 – ). Misalnya: kalium superoksida (KO 2 ).
- Jumlah aljabar bilangan oksidasi atom-atom penyusun senyawa netral adalah nol.
- Jumlah aljabar bilangan oksidasi atom-atom penyusun ion poliatomik sama dengan muatan ion tersebut. Contoh: anion sulfat (SO 4 2- ) mempunyai bilangan oksidasi -2 yang sama dengan jumlah bilangan oksidasi sulfur dan oksigen, masing-masing dikalikan dengan jumlah masing-masing atom dalam senyawa, dalam hal ini, ia memiliki satu atom belerang dan empat atom oksigen.
- Bilangan oksidasi beberapa unsur kimia dapat bervariasi tergantung pada senyawa atau ion netral yang menjadi bagiannya. Kemudian, bilangan oksidasi suatu atom dalam suatu senyawa dapat dihitung dengan cara berikut:

Dimana no() berarti bilangan oksidasi, dan unsur kimianya ada di dalam tanda kurung.
Dengan cara ini, dalam setiap reaksi redoks terdapat dua jenis reaktan, satu reaktan yang melepaskan elektron dan satu lagi yang menerimanya :
-
- Agen pengoksidasi. Atomlah yang menangkap elektron. Dalam hal ini, bilangan oksidasi awalnya menurun, dan terjadi reduksi. Dengan cara ini, muatan listrik negatifnya meningkat dengan bertambahnya elektron.
- Agen pereduksi. Atomlah yang melepaskan elektron dan meningkatkan bilangan oksidasi awalnya, mengalami oksidasi. Dengan cara ini, muatan listrik positifnya meningkat dengan melepaskan elektron.
Beberapa unsur kimia dapat dioksidasi dan direduksi secara bersamaan. Unsur-unsur ini disebut amfolit dan proses terjadinya hal ini disebut amfolit.
Reaksi redoks adalah salah satu reaksi kimia yang paling umum di alam semesta, karena merupakan bagian dari proses fotosintesis pada tumbuhan dan respirasi pada hewan, yang memungkinkan kelangsungan kehidupan.
Ini dapat membantu Anda: Pengoksidasi
Jenis-Jenis Reaksi Redoks
Reaksi redoks dapat diklasifikasikan berdasarkan berbagai kriteria, termasuk jenis zat yang terlibat dan sifat reaksi itu sendiri. Berikut adalah beberapa jenis reaksi redoks yang umum:
1. Reaksi Oksidasi
Reaksi oksidasi adalah proses di mana suatu zat kehilangan elektron dan mengalami peningkatan bilangan oksidasi. Contoh sederhana adalah oksidasi logam besi menjadi besi(III) oksida (karat):
4 Fe + 3 O₂ → 2 Fe₂O₃2. Reaksi Reduksi
Reaksi reduksi adalah proses di mana suatu zat menerima elektron dan mengalami penurunan bilangan oksidasi. Contoh adalah reduksi ion tembaga(II) menjadi tembaga metalik:
Cu²⁺ + 2 e⁻ → Cu3. Reaksi Disproporsionasi
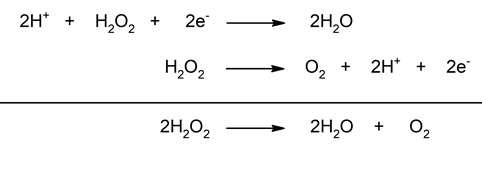
Reaksi disproporsionasi adalah jenis reaksi redoks di mana satu zat mengalami oksidasi dan reduksi secara simultan, menghasilkan dua produk yang berbeda. Contoh adalah disproporsionasi hidrogen peroksida:
2 H₂O₂ → 2 H₂O + O₂4. Reaksi Sintesis Redoks
Reaksi sintesis redoks melibatkan pembentukan senyawa baru melalui reaksi redoks. Contoh adalah pembentukan air dari hidrogen dan oksigen:
2 H₂ + O₂ → 2 H₂O5. Reaksi Dekomposisi Redoks
Reaksi dekomposisi redoks melibatkan penguraian senyawa menjadi dua atau lebih produk melalui reaksi redoks. Contoh adalah dekomposisi kalium klorat menjadi kalium klorida dan oksigen:
2 KClO₃ → 2 KCl + 3 O₂Ciri-ciri reaksi redoks
Reaksi redoks banyak ditemui disekitar kita setiap hari. Oksidasi logam, pembakaran gas di dapur atau bahkan oksidasi glukosa untuk memperoleh ATP dalam tubuh kita adalah beberapa contohnya.
Dalam kebanyakan kasus, reaksi redoks melepaskan sejumlah besar energi.
Biasanya, setiap reaksi redoks terdiri dari dua langkah atau setengah reaksi. Pada salah satu setengah reaksi terjadi oksidasi (reaktan teroksidasi) dan pada setengah reaksi lainnya terjadi reduksi (reaktan tereduksi).
Reaksi redoks total, yang diperoleh dengan menggabungkan semua setengah reaksi secara aljabar, biasanya disebut “reaksi global”. Penting untuk dicatat bahwa ketika setengah reaksi digabungkan secara aljabar, massa dan muatannya harus disesuaikan. Artinya, jumlah elektron yang dilepaskan selama oksidasi harus sama dengan jumlah elektron yang diperoleh selama reduksi, dan massa setiap reaktan harus sama dengan massa setiap produk.
Misalnya:
-
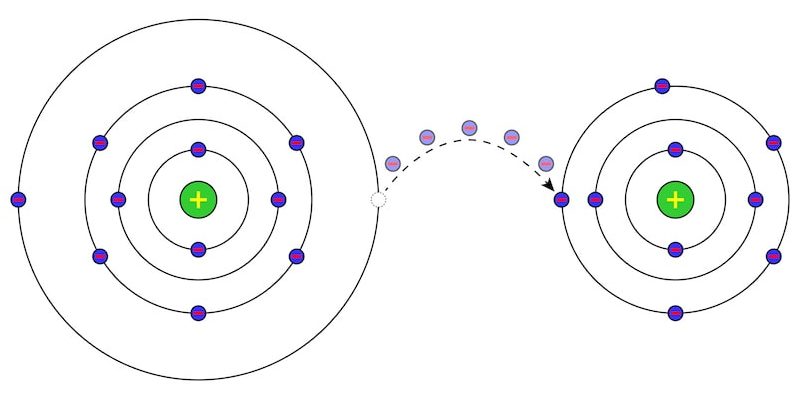
- Setengah reaksi reduksi. Reduksi tembaga dengan menangkap dua elektron. Ini menurunkan bilangan oksidasinya.
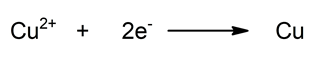
- Setengah reaksi oksidasi. Oksidasi besi dengan kehilangan dua elektron. Ini meningkatkan keadaan oksidasinya.
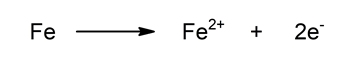 Reaksi global:
Reaksi global: 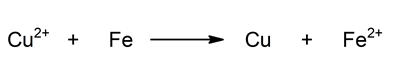
- Setengah reaksi reduksi. Reduksi tembaga dengan menangkap dua elektron. Ini menurunkan bilangan oksidasinya.
Contoh reaksi redoks
Contoh reaksi redoks sangat banyak. Kami akan mencoba memberikan contoh masing-masing jenis yang dijelaskan di atas:
-
- Pembakaran oktan. Oktan adalah komponen hidrokarbon bensin yang digunakan untuk menggerakkan mesin mobil kita. Ketika oktan bereaksi dengan oksigen, oktan teroksidasi dan oksigen tereduksi, sehingga melepaskan sejumlah besar energi sebagai hasil dari reaksi ini. Energi yang dilepaskan ini digunakan untuk menghasilkan kerja pada mesin, juga menghasilkan karbon dioksida dan uap air dalam prosesnya. Persamaan yang mewakili reaksi ini adalah:
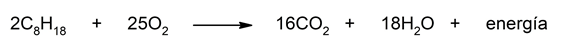
- Penguraian hidrogen peroksida. Ini adalah reaksi dismutasi di mana hidrogen peroksida terurai menjadi unsur penyusunnya, air dan oksigen. Dalam reaksi ini, oksigen direduksi dengan menurunkan bilangan oksidasi dari -1 (H 2 O 2 ) menjadi -2 (H 2 O), dan dioksidasi dengan meningkatkan bilangan oksidasi dari -1 (H 2 O 2 ) menjadi 0 ( Atau 2 ).
- Perpindahan perak oleh tembaga. Ini adalah reaksi perpindahan sederhana di mana Anda dapat melihat bagaimana ketika Anda merendam sebuah fragmen logam tembaga dalam larutan perak nitrat, warna larutan berubah menjadi biru dan lapisan tipis logam perak diendapkan pada fragmen tembaga. Dalam hal ini, sebagian logam tembaga (Cu) diubah menjadi ion Cu 2+ , sebagai bagian dari tembaga (II) nitrat (Cu(NO 3 ) 2 ), yang larutannya mempunyai warna biru yang bagus. Sebaliknya, sebagian kation Ag + yang merupakan bagian dari perak nitrat (AgNO 3 ) diubah menjadi logam perak (Ag) yang diendapkan.

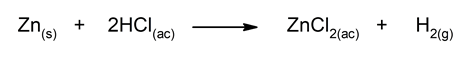
- Reaksi seng dengan asam klorida encer. Ini adalah reaksi perpindahan sederhana di mana hidrogen dari HCl (aq) digantikan oleh seng untuk membentuk garam.
- Oksidasi besi. Besi logam teroksidasi ketika bersentuhan dengan oksigen di udara. Hal ini terlihat dalam kehidupan sehari-hari ketika lapisan karat berwarna coklat terbentuk pada benda besi jika terkena udara dalam waktu lama. Dalam reaksi ini, besi logam (Fe) yang mempunyai bilangan oksidasi 0 diubah menjadi Fe3+, yaitu bilangan oksidasinya meningkat (teroksidasi). Oleh karena itu, secara intuitif atau bahasa sehari-hari dikatakan: besi berkarat.
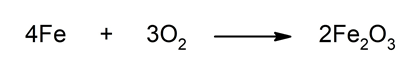
- Pembakaran oktan. Oktan adalah komponen hidrokarbon bensin yang digunakan untuk menggerakkan mesin mobil kita. Ketika oktan bereaksi dengan oksigen, oktan teroksidasi dan oksigen tereduksi, sehingga melepaskan sejumlah besar energi sebagai hasil dari reaksi ini. Energi yang dilepaskan ini digunakan untuk menghasilkan kerja pada mesin, juga menghasilkan karbon dioksida dan uap air dalam prosesnya. Persamaan yang mewakili reaksi ini adalah:
Aplikasi industri

Di pembangkit listrik, reaksi redoks menggerakkan mesin besar.
Penerapan reaksi redoks dalam industri tidak terbatas. Misalnya, reaksi pembakaran ideal untuk menghasilkan kerja yang digunakan untuk menghasilkan pergerakan pada mesin besar yang digunakan di pembangkit listrik untuk menghasilkan listrik.
Prosesnya terdiri dari pembakaran bahan bakar fosil untuk memperoleh panas dan menghasilkan uap air di dalam boiler, kemudian uap air tersebut digunakan untuk menggerakkan mesin atau turbin besar. Di sisi lain, reaksi pembakaran juga digunakan untuk menggerakkan mesin kendaraan bermotor yang menggunakan bahan bakar fosil, seperti mobil kita.
Di sisi lain, reaksi substitusi dan perpindahan redoks berguna untuk memperoleh unsur-unsur tertentu dalam keadaan kemurnian yang jarang terlihat di alam. Misalnya, perak sangat reaktif. Meskipun jarang ditemukan murni di lapisan tanah mineral, tingkat kemurnian yang tinggi dapat diperoleh melalui reaksi redoks. Hal yang sama terjadi ketika memperoleh garam dan senyawa lainnya.
Lanjutkan dengan: Metabolisme
Mekanisme Reaksi Redoks
Reaksi redoks melibatkan perubahan bilangan oksidasi zat yang terlibat. Bilangan oksidasi adalah angka yang menunjukkan jumlah elektron yang hilang atau diterima oleh suatu atom dalam suatu molekul. Berikut adalah langkah-langkah umum dalam mekanisme reaksi redoks:
1. Menentukan Bilangan Oksidasi
Langkah pertama dalam menganalisis reaksi redoks adalah menentukan bilangan oksidasi setiap atom dalam reaktan dan produk. Aturan-aturan untuk menentukan bilangan oksidasi meliputi:
- Bilangan oksidasi unsur bebas adalah 0 (misalnya, O₂, H₂, N₂).
- Bilangan oksidasi ion monoatomik sama dengan muatan ion tersebut (misalnya, Na⁺ = +1, Cl⁻ = -1).
- Bilangan oksidasi hidrogen dalam senyawa adalah +1, kecuali dalam hidrida logam di mana hidrogen adalah -1.
- Bilangan oksidasi oksigen dalam senyawa adalah -2, kecuali dalam peroksida di mana oksigen adalah -1.
2. Menulis Setengah Reaksi
Reaksi redoks dapat dipecah menjadi dua setengah reaksi: setengah reaksi oksidasi dan setengah reaksi reduksi. Masing-masing setengah reaksi menunjukkan transfer elektron yang terjadi.
3. Menyeimbangkan Setengah Reaksi
Setelah menulis setengah reaksi, langkah berikutnya adalah menyeimbangkan jumlah atom dan muatan dalam masing-masing setengah reaksi. Ini termasuk menambahkan elektron untuk menyeimbangkan muatan.
4. Menggabungkan Setengah Reaksi
Langkah terakhir adalah menggabungkan setengah reaksi oksidasi dan reduksi untuk mendapatkan reaksi redoks keseluruhan. Jumlah elektron yang hilang dalam setengah reaksi oksidasi harus sama dengan jumlah elektron yang diterima dalam setengah reaksi reduksi.
Pentingnya Reaksi Redoks dalam Kehidupan
Reaksi redoks memiliki peran penting dalam berbagai aspek kehidupan dan teknologi. Berikut adalah beberapa contoh pentingnya reaksi redoks:
1. Metabolisme Energi
Dalam organisme hidup, reaksi redoks memainkan peran kunci dalam metabolisme energi. Proses respirasi seluler, di mana glukosa diubah menjadi energi (ATP), melibatkan serangkaian reaksi redoks. Oksidasi glukosa dan reduksi oksigen menghasilkan energi yang diperlukan untuk aktivitas sel.
2. Fotosintesis
Fotosintesis adalah proses di mana tumbuhan hijau mengubah energi matahari menjadi energi kimia dalam bentuk glukosa. Proses ini melibatkan reaksi redoks di mana air dioksidasi menjadi oksigen dan karbon dioksida direduksi menjadi glukosa.
3. Korosi
Korosi adalah proses redoks yang merusak di mana logam, seperti besi, mengalami oksidasi dalam lingkungan yang lembab, menghasilkan karat. Ini adalah masalah besar dalam industri dan konstruksi, membutuhkan langkah-langkah perlindungan khusus.
4. Produksi Kimia
Banyak reaksi industri melibatkan reaksi redoks, termasuk produksi logam dari bijih mereka, sintesis bahan kimia, dan pemurnian minyak bumi. Reaksi redoks digunakan untuk menghasilkan berbagai produk yang penting bagi kehidupan sehari-hari.
5. Teknologi Energi
Baterai dan sel bahan bakar adalah contoh teknologi yang memanfaatkan reaksi redoks untuk menghasilkan listrik. Dalam baterai, reaksi redoks terjadi antara elektroda dan elektrolit, menghasilkan arus listrik yang dapat digunakan untuk menggerakkan perangkat elektronik.
Kesimpulan
Reaksi redoks adalah proses kimia yang melibatkan transfer elektron antara zat yang mengalami oksidasi dan reduksi. Jenis-jenis reaksi redoks meliputi oksidasi, reduksi, disproporsionasi, sintesis redoks, dan dekomposisi redoks. Mekanisme reaksi redoks melibatkan penentuan bilangan oksidasi, penulisan setengah reaksi, penyeimbangan setengah reaksi, dan penggabungan setengah reaksi. Reaksi redoks memiliki peran penting dalam berbagai aspek kehidupan, termasuk metabolisme energi, fotosintesis, korosi, produksi kimia, dan teknologi energi.
