Konstanta keseimbangan adalah salah satu konsep fundamental dalam kimia yang menggambarkan hubungan antara konsentrasi reaktan dan produk dalam suatu reaksi kimia pada keadaan keseimbangan. Konsep ini sangat penting dalam memahami bagaimana reaksi kimia berlangsung dan bagaimana faktor-faktor tertentu dapat mempengaruhi posisi keseimbangan. Dalam artikel ini, kita akan membahas secara mendetail tentang konstanta keseimbangan, termasuk pengertian, rumus, faktor-faktor yang mempengaruhi, serta aplikasi dalam berbagai bidang.
Pengertian Konstanta Keseimbangan
Konstanta keseimbangan, yang sering dilambangkan dengan ![]() , adalah nilai yang menunjukkan rasio konsentrasi produk dan reaktan pada saat reaksi kimia mencapai keadaan keseimbangan. Pada titik ini, laju reaksi maju (reaksi yang menghasilkan produk) sama dengan laju reaksi mundur (reaksi yang menghasilkan reaktan), sehingga konsentrasi reaktan dan produk tetap konstan seiring berjalannya waktu.
, adalah nilai yang menunjukkan rasio konsentrasi produk dan reaktan pada saat reaksi kimia mencapai keadaan keseimbangan. Pada titik ini, laju reaksi maju (reaksi yang menghasilkan produk) sama dengan laju reaksi mundur (reaksi yang menghasilkan reaktan), sehingga konsentrasi reaktan dan produk tetap konstan seiring berjalannya waktu.
Secara umum, untuk reaksi kimia yang dinyatakan sebagai:
![]()
Di mana:
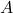 dan
dan 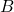 adalah reaktan,
adalah reaktan,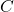 dan
dan 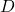 adalah produk,
adalah produk, ,
, 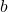 ,
,  , dan
, dan 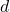 adalah koefisien stoikiometri.
adalah koefisien stoikiometri.
Konstanta keseimbangan (![]() ) dapat dinyatakan dengan rumus:
) dapat dinyatakan dengan rumus:
![]()
Di mana:
![Rendered by QuickLaTeX.com [C]](https://pengayaan.com/wp-content/uploads/2025/07/img_68678d2785eab.png) ,
, ![Rendered by QuickLaTeX.com [D]](https://pengayaan.com/wp-content/uploads/2025/07/img_68678d27a2c17.png) ,
, ![Rendered by QuickLaTeX.com [A]](https://pengayaan.com/wp-content/uploads/2025/07/img_68678d27b7fbe.png) , dan
, dan ![Rendered by QuickLaTeX.com [B]](https://pengayaan.com/wp-content/uploads/2025/07/img_68678d27d17e4.png) adalah konsentrasi molar dari masing-masing spesies pada keadaan keseimbangan.
adalah konsentrasi molar dari masing-masing spesies pada keadaan keseimbangan.
Jenis-Jenis Konstanta Keseimbangan
Konstanta keseimbangan dapat dibedakan menjadi beberapa jenis berdasarkan jenis reaksi yang terjadi:
1. Konstanta Keseimbangan untuk Reaksi Gas: Untuk reaksi yang melibatkan gas, konstanta keseimbangan dapat dinyatakan dalam tekanan parsial. Dalam hal ini, rumusnya menjadi:
![]()
Di mana ![]() adalah tekanan parsial dari masing-masing gas.
adalah tekanan parsial dari masing-masing gas.
2. Konstanta Keseimbangan untuk Reaksi dalam Larutan: Untuk reaksi yang terjadi dalam larutan, konstanta keseimbangan biasanya dinyatakan dalam konsentrasi molar.
3. Konstanta Keseimbangan untuk Reaksi Endotermik dan Eksotermik: Posisi keseimbangan dan nilai konstanta keseimbangan dapat dipengaruhi oleh perubahan suhu. Untuk reaksi endotermik, peningkatan suhu akan meningkatkan nilai ![]() , sedangkan untuk reaksi eksotermik, peningkatan suhu akan menurunkan nilai
, sedangkan untuk reaksi eksotermik, peningkatan suhu akan menurunkan nilai ![]() .
.
Faktor-Faktor yang Mempengaruhi Konstanta Keseimbangan
Meskipun konstanta keseimbangan (![]() ) sendiri adalah nilai tetap pada suhu tertentu, ada beberapa faktor yang dapat mempengaruhi posisi keseimbangan reaksi:
) sendiri adalah nilai tetap pada suhu tertentu, ada beberapa faktor yang dapat mempengaruhi posisi keseimbangan reaksi:
1. Konsentrasi: Perubahan konsentrasi reaktan atau produk dapat mempengaruhi posisi keseimbangan. Menambah konsentrasi reaktan akan mendorong reaksi maju, sedangkan menambah konsentrasi produk akan mendorong reaksi mundur.
2. Tekanan: Untuk reaksi gas, perubahan tekanan dapat mempengaruhi posisi keseimbangan. Meningkatkan tekanan akan mendorong reaksi ke arah yang menghasilkan lebih sedikit mol gas. Sebaliknya, menurunkan tekanan akan mendorong reaksi ke arah yang menghasilkan lebih banyak mol gas.
3. Suhu: Seperti yang telah disebutkan, suhu dapat mempengaruhi nilai konstanta keseimbangan. Untuk reaksi endotermik, peningkatan suhu akan meningkatkan nilai ![]() , sedangkan untuk reaksi eksotermik, peningkatan suhu akan menurunkan nilai
, sedangkan untuk reaksi eksotermik, peningkatan suhu akan menurunkan nilai ![]() .
.
4. Katalis: Katalis tidak mempengaruhi nilai konstanta keseimbangan, tetapi dapat mempercepat laju pencapaian keseimbangan tanpa mengubah posisi keseimbangan itu sendiri.
Aplikasi Konstanta Keseimbangan
Konstanta keseimbangan memiliki banyak aplikasi dalam berbagai bidang, termasuk:
1. Kimia Analitik: Dalam analisis kimia, konstanta keseimbangan digunakan untuk menentukan konsentrasi spesies dalam larutan. Ini sangat berguna dalam titrasi dan analisis kuantitatif.
2. Reaksi Biokimia: Dalam biokimia, konstanta keseimbangan digunakan untuk memahami reaksi enzimatik dan metabolisme. Ini membantu dalam merancang eksperimen dan memahami jalur metabolik.
3. Industri Kimia: Dalam industri, pemahaman tentang konstanta keseimbangan sangat penting untuk merancang reaktor dan proses produksi. Ini membantu dalam mengoptimalkan kondisi reaksi untuk memaksimalkan hasil produk.
4. Lingkungan: Konstanta keseimbangan juga digunakan dalam studi reaksi kimia yang terjadi di lingkungan, seperti reaksi antara polutan dan zat lain dalam air atau udara. Ini membantu dalam memahami dampak polusi dan merancang strategi mitigasi.
5. Farmasi: Dalam pengembangan obat, konstanta keseimbangan digunakan untuk memahami interaksi antara obat dan reseptor, serta untuk merancang formulasi yang efektif.
Contoh Konstanta Keseimbangan
Sebagai contoh, mari kita lihat reaksi pembentukan amonia dari nitrogen dan hidrogen:
![]()
Konstanta keseimbangan untuk reaksi ini dapat dinyatakan sebagai:
![]()
Jika pada keadaan keseimbangan, konsentrasi amonia adalah 0,5 M, konsentrasi nitrogen adalah 0,2 M, dan konsentrasi hidrogen adalah 0,6 M, maka nilai konstanta keseimbangan dapat dihitung sebagai berikut:
![]()
Dengan menghitung nilai tersebut, kita dapat menentukan sejauh mana reaksi telah berlangsung dan bagaimana konsentrasi spesies berubah pada keadaan keseimbangan.
Kesimpulan
Konstanta keseimbangan adalah konsep penting dalam kimia yang menggambarkan hubungan antara konsentrasi reaktan dan produk pada keadaan keseimbangan. Dengan memahami konstanta keseimbangan, kita dapat lebih baik memahami bagaimana reaksi kimia berlangsung dan bagaimana berbagai faktor dapat mempengaruhi posisi keseimbangan. Aplikasi konstanta keseimbangan sangat luas, mulai dari kimia analitik hingga industri dan biokimia. Dengan pengetahuan ini, kita dapat lebih menghargai kompleksitas reaksi kimia dan peran pentingnya dalam berbagai aspek kehidupan.
