Reaksi endergonik adalah salah satu jenis reaksi kimia yang memerlukan input energi dari lingkungan untuk berlangsung. Dalam reaksi ini, energi yang dibutuhkan untuk memecah ikatan kimia dalam reaktan lebih besar daripada energi yang dilepaskan saat produk terbentuk. Akibatnya, reaksi ini tidak dapat terjadi secara spontan dan memerlukan sumber energi eksternal, seperti cahaya, panas, atau energi kimia. Reaksi endergonik sangat penting dalam berbagai proses biologis dan industri, termasuk fotosintesis, sintesis biomolekul, dan banyak reaksi kimia lainnya. Artikel ini akan membahas secara mendetail tentang reaksi endergonik, termasuk pengertian, karakteristik, proses yang terlibat, serta contoh-contoh dalam kehidupan sehari-hari.
Pengertian Reaksi Endergonik
Reaksi endergonik adalah reaksi kimia yang memerlukan energi untuk berlangsung. Dalam istilah termodinamika, reaksi ini memiliki perubahan energi bebas Gibbs (![]() ) yang positif. Energi bebas Gibbs adalah ukuran dari energi yang tersedia untuk melakukan kerja dalam sistem. Ketika
) yang positif. Energi bebas Gibbs adalah ukuran dari energi yang tersedia untuk melakukan kerja dalam sistem. Ketika ![]() positif, ini menunjukkan bahwa reaksi tidak dapat terjadi secara spontan dan memerlukan input energi dari luar untuk mencapai keadaan produk.
positif, ini menunjukkan bahwa reaksi tidak dapat terjadi secara spontan dan memerlukan input energi dari luar untuk mencapai keadaan produk.
Secara matematis, reaksi endergonik dapat dinyatakan sebagai:
![]()
Di mana:
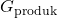 adalah energi bebas Gibbs dari produk,
adalah energi bebas Gibbs dari produk,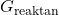 adalah energi bebas Gibbs dari reaktan.
adalah energi bebas Gibbs dari reaktan.
Karakteristik Reaksi Endergonik
Reaksi endergonik memiliki beberapa karakteristik yang membedakannya dari reaksi eksotermik dan reaksi eksergonik:
1. Memerlukan Energi: Reaksi ini memerlukan input energi dari lingkungan untuk memecah ikatan kimia dalam reaktan. Energi ini dapat berasal dari berbagai sumber, seperti cahaya, panas, atau reaksi kimia lainnya.
2. Perubahan Energi Positif: Dalam reaksi endergonik, perubahan energi bebas Gibbs (![]() ) adalah positif, yang menunjukkan bahwa reaksi tidak dapat terjadi secara spontan.
) adalah positif, yang menunjukkan bahwa reaksi tidak dapat terjadi secara spontan.
3. Reaksi Non-Spontan: Reaksi endergonik tidak akan terjadi tanpa adanya energi tambahan. Oleh karena itu, reaksi ini sering kali dikatalisis oleh enzim atau memerlukan kondisi tertentu untuk berlangsung.
4. Contoh dalam Proses Biologis: Banyak proses biologis yang melibatkan reaksi endergonik, seperti sintesis biomolekul, transportasi ion melawan gradien konsentrasi, dan fotosintesis.
Proses Reaksi Endergonik
Proses reaksi endergonik dapat dijelaskan dalam beberapa langkah:
1. Input Energi: Energi dari lingkungan, seperti cahaya matahari atau energi kimia, diperlukan untuk memulai reaksi. Energi ini digunakan untuk memecah ikatan dalam reaktan.
2. Pembentukan Produk: Setelah ikatan dalam reaktan terputus, atom-atom dapat bergabung kembali untuk membentuk produk baru. Proses ini memerlukan energi tambahan untuk membentuk ikatan baru.
3. Energi Bebas Gibbs: Selama reaksi, perubahan energi bebas Gibbs dihitung. Jika ![]() positif, reaksi dianggap endergonik dan tidak dapat terjadi tanpa input energi.
positif, reaksi dianggap endergonik dan tidak dapat terjadi tanpa input energi.
4. Katalisis: Dalam banyak kasus, reaksi endergonik dapat dipercepat dengan bantuan katalis, yang menurunkan energi aktivasi yang diperlukan untuk memulai reaksi.
Contoh Reaksi Endergonik
Berikut adalah beberapa contoh reaksi endergonik yang umum ditemukan dalam kehidupan sehari-hari dan proses biologis:
1. Fotosintesis: Proses fotosintesis pada tumbuhan adalah contoh klasik dari reaksi endergonik. Dalam fotosintesis, tumbuhan menggunakan energi dari sinar matahari untuk mengubah karbon dioksida dan air menjadi glukosa dan oksigen. Reaksi ini dapat dituliskan sebagai:
![]()
Dalam reaksi ini, energi dari cahaya matahari diperlukan untuk mengubah reaktan menjadi produk.
2. Sintesis Protein: Proses sintesis protein dalam sel juga melibatkan reaksi endergonik. Amino asam bergabung untuk membentuk rantai polipeptida, yang memerlukan energi dari ATP (adenosin trifosfat) untuk membentuk ikatan peptida.
3. Transportasi Aktif: Dalam sel, transportasi ion melawan gradien konsentrasi adalah contoh reaksi endergonik. Misalnya, pompa natrium-kalium (Na+/K+) memindahkan natrium keluar dari sel dan kalium ke dalam sel, memerlukan energi dari ATP untuk melawan gradien konsentrasi.
4. Reaksi Kimia dalam Industri: Banyak reaksi kimia dalam industri, seperti sintesis amonia (Haber process), juga merupakan reaksi endergonik. Proses ini memerlukan energi tinggi untuk mengubah nitrogen dan hidrogen menjadi amonia.
Aplikasi Reaksi Endergonik
Reaksi endergonik memiliki banyak aplikasi dalam berbagai bidang, termasuk:
1. Biologi: Memahami reaksi endergonik sangat penting dalam biokimia dan fisiologi, terutama dalam konteks metabolisme sel dan proses biologis lainnya.
2. Industri: Dalam industri kimia, reaksi endergonik digunakan dalam sintesis bahan kimia, obat-obatan, dan produk lainnya. Pengetahuan tentang reaksi ini membantu dalam merancang proses yang efisien dan ekonomis.
3. Energi Terbarukan: Reaksi endergonik juga berperan dalam pengembangan teknologi energi terbarukan, seperti sel surya, di mana energi dari cahaya matahari digunakan untuk menghasilkan energi listrik.
4. Pertanian: Dalam pertanian, pemahaman tentang reaksi endergonik dapat membantu dalam pengembangan pupuk dan teknik pertanian yang lebih efisien, yang mendukung pertumbuhan tanaman.
Kesimpulan
Reaksi endergonik adalah proses kimia yang memerlukan input energi dari lingkungan untuk berlangsung. Dengan karakteristik yang unik, reaksi ini memainkan peran penting dalam berbagai proses biologis dan industri. Dari fotosintesis hingga sintesis protein dan transportasi aktif, reaksi endergonik membantu menjelaskan bagaimana energi digunakan dan dikelola dalam sistem biologis. Memahami reaksi endergonik tidak hanya penting dalam konteks ilmiah, tetapi juga memiliki aplikasi praktis yang luas dalam kehidupan sehari-hari dan pengembangan teknologi. Dengan pengetahuan ini, kita dapat lebih menghargai kompleksitas dan keindahan proses kimia yang terjadi di sekitar kita.
