Termodinamika adalah cabang ilmu fisika yang mempelajari hubungan antara kalor, energi, dan kerja dalam suatu sistem. Secara sederhana, termodinamika menjelaskan bagaimana energi berpindah dari satu bentuk ke bentuk lain dan bagaimana energi tersebut berinteraksi dengan materi dalam berbagai kondisi.

Termodinamika sangat penting karena konsep ini digunakan untuk memahami berbagai fenomena alam dan teknologi, mulai dari mesin uap, motor kendaraan, hingga proses biologis di dalam tubuh kita. Dalam artikel ini, kita akan membahas secara detail apa itu termodinamika, prinsip-prinsip dasarnya, dan memberikan perumpamaan sederhana untuk memudahkan pemahaman.
1. Konsep Dasar Termodinamika
Pada intinya, termodinamika berurusan dengan energi dan bagaimana energi tersebut dapat berubah bentuk, berpindah, atau digunakan untuk melakukan kerja. Dalam termodinamika, kita sering berbicara tentang sistem dan lingkungan.
- Sistem: Bagian dari alam semesta yang sedang kita pelajari atau amati.
- Lingkungan: Segala sesuatu di luar sistem yang dapat berinteraksi dengan sistem tersebut.
Tiga Bentuk Energi Utama dalam Termodinamika:
1. Kalor: Energi yang berpindah karena adanya perbedaan suhu.
2. Kerja: Energi yang digunakan untuk memindahkan atau mengubah bentuk objek (misalnya, mendorong benda atau menggerakkan piston).
3. Energi Dalam: Total energi yang terkandung dalam sistem, termasuk energi kinetik dan potensial partikel-partikel di dalamnya.
—
2. Hukum-Hukum Termodinamika
Termodinamika didasarkan pada empat hukum dasar yang membantu kita memahami bagaimana energi dan kalor berinteraksi dalam suatu sistem. Hukum-hukum ini adalah dasar dari banyak aplikasi dalam fisika, kimia, dan teknik.
a. Hukum Ke-0 Termodinamika (Kesetimbangan Termal)
Hukum ini menyatakan bahwa jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka kedua sistem tersebut juga berada dalam kesetimbangan termal satu sama lain. Ini adalah dasar dari konsep suhu.
Perumpamaan Sederhana:
Bayangkan Anda memiliki tiga cangkir kopi. Jika cangkir pertama dan kedua memiliki suhu yang sama (mereka dalam kesetimbangan termal), dan cangkir kedua dan ketiga juga memiliki suhu yang sama, maka cangkir pertama dan ketiga juga harus memiliki suhu yang sama.
b. Hukum Pertama Termodinamika (Hukum Kekekalan Energi)
Hukum pertama menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, tetapi hanya dapat diubah dari satu bentuk ke bentuk lain. Jika energi masuk atau keluar dari suatu sistem, itu akan mempengaruhi energi dalam sistem tersebut.
Secara matematis, hukum ini sering dituliskan sebagai:
![]()
Di mana:
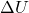 adalah perubahan energi dalam sistem.
adalah perubahan energi dalam sistem.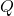 adalah kalor yang ditambahkan ke sistem.
adalah kalor yang ditambahkan ke sistem.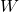 adalah kerja yang dilakukan oleh sistem.
adalah kerja yang dilakukan oleh sistem.
Perumpamaan Sederhana:
Bayangkan Anda memiliki uang di dompet (energi dalam). Jika Anda menerima uang dari seseorang (kalor masuk), total uang Anda bertambah. Jika Anda membelanjakan uang untuk membeli sesuatu (melakukan kerja), total uang Anda berkurang. Tetapi, jumlah total uang selalu terjaga—tidak hilang begitu saja.
c. Hukum Kedua Termodinamika (Entropi dan Irreversibilitas)
Hukum kedua menyatakan bahwa dalam setiap proses termodinamika, entropi (tingkat ketidakteraturan atau kekacauan) dari suatu sistem tertutup akan selalu meningkat atau tetap sama, tetapi tidak pernah berkurang. Ini berarti bahwa energi cenderung menyebar dan menjadi kurang berguna untuk melakukan kerja.
Hukum ini juga berarti bahwa tidak mungkin menciptakan mesin yang 100% efisien; selalu ada sebagian energi yang hilang sebagai panas atau tidak dapat digunakan.
Perumpamaan Sederhana:
Bayangkan Anda melemparkan setumpuk kartu secara acak ke udara. Ketika kartu jatuh, mereka akan tersebar secara acak (entropi meningkat). Sangat sulit, atau bahkan mustahil, bagi kartu-kartu tersebut jatuh dengan rapi dan tersusun kembali seperti sebelumnya (entropi berkurang).
d. Hukum Ketiga Termodinamika (Suhu Nol Absolut)
Hukum ketiga menyatakan bahwa saat suhu suatu sistem mendekati nol absolut (0 Kelvin atau -273,15°C), entropi sistem tersebut akan mendekati nilai minimum yang konstan. Pada suhu nol absolut, gerakan molekul-molekul akan mencapai titik paling lambat, dan secara teoritis, tidak ada energi termal yang tersisa.
Perumpamaan Sederhana:
Bayangkan Anda berada di ruangan yang sangat dingin dan semakin dingin hingga semua gerakan berhenti total. Ini adalah gambaran dari nol absolut, di mana tidak ada energi tersisa untuk membuat molekul bergerak.
—
3. Proses Termodinamika
Dalam termodinamika, ada beberapa proses penting yang melibatkan perubahan energi dan kalor dalam suatu sistem. Berikut beberapa di antaranya:
a. Isotermal: Suhu konstan
Pada proses isotermal, suhu sistem tetap konstan, tetapi energi dapat berpindah sebagai kalor atau kerja. Kalor masuk atau keluar dari sistem, tetapi total energi dalam sistem tidak berubah.
Perumpamaan Sederhana:
Bayangkan Anda sedang memanaskan air dalam panci dengan api kecil. Suhu air tetap sama karena sebagian besar energi panas digunakan untuk menguapkan air, bukan untuk menaikkan suhunya.
b. Adiabatik: Tidak ada pertukaran kalor
Dalam proses adiabatik, tidak ada kalor yang masuk atau keluar dari sistem. Semua perubahan energi dalam sistem terjadi karena perubahan kerja, bukan karena penambahan atau pelepasan kalor.
Perumpamaan Sederhana:
Bayangkan Anda sedang memompa udara ke dalam ban sepeda. Udara di dalam ban memanas karena Anda melakukan kerja pada udara, namun tidak ada panas yang masuk atau keluar dari ban.
c. Isobarik: Tekanan konstan
Pada proses isobarik, tekanan dalam sistem tetap konstan, tetapi suhu dan volume bisa berubah.
Perumpamaan Sederhana:
Bayangkan Anda sedang memanaskan balon. Saat balon dipanaskan, volumenya bertambah, tetapi tekanan di dalam balon tetap sama karena udara di dalamnya mengembang.
d. Isokhorik: Volume konstan
Dalam proses isokhorik, volume sistem tetap konstan. Karena sistem tidak bisa mengembang atau menyusut, semua energi yang masuk atau keluar terjadi dalam bentuk perubahan suhu.
Perumpamaan Sederhana:
Bayangkan Anda memanaskan gas dalam wadah tertutup yang tidak bisa berubah bentuk. Karena volume wadah tidak bisa bertambah, energi yang ditambahkan akan meningkatkan suhu gas tanpa mengubah volumenya.
—
4. Entropi: Ukuran Ketidakteraturan
Salah satu konsep paling penting dalam termodinamika adalah entropi. Entropi adalah ukuran dari ketidakteraturan atau kekacauan dalam suatu sistem. Semakin tinggi entropi suatu sistem, semakin tidak teratur sistem tersebut.
- Dalam proses alami, entropi selalu cenderung bertambah. Ini berarti bahwa sistem akan berusaha bergerak ke kondisi yang lebih tidak teratur seiring waktu.
- Entropi juga dapat dihubungkan dengan efisiensi mesin. Mesin yang lebih efisien memiliki entropi yang lebih rendah, karena lebih sedikit energi yang diubah menjadi bentuk yang tidak berguna seperti panas.
Perumpamaan Sederhana:
Bayangkan Anda memiliki kamar yang rapi dan terorganisir. Seiring berjalannya waktu, tanpa Anda sadari, barang-barang akan mulai berantakan (entropi meningkat). Untuk merapikannya kembali, Anda harus mengeluarkan energi (kerja). Kamar yang semakin berantakan mencerminkan peningkatan entropi.
—
5. Aplikasi Termodinamika dalam Kehidupan Sehari-hari
Termodinamika tidak hanya teori abstrak, tetapi juga memiliki banyak aplikasi praktis dalam kehidupan sehari-hari dan teknologi. Beberapa di antaranya meliputi:
a. Mesin Pembakaran Internal
Mesin mobil bekerja berdasarkan prinsip termodinamika, khususnya dalam siklus Carnot atau Otto. Ketika bahan bakar terbakar di dalam mesin, energi kalor diubah menjadi energi mekanik untuk menggerakkan kendaraan.
b. Kulkas dan AC
Perangkat pendingin seperti kulkas dan AC bekerja dengan mengalirkan kalor dari dalam ke luar. Mereka menggunakan prinsip kerja siklus termodinamika yang melibatkan proses kompresi dan ekspansi gas untuk menyerap kalor dari dalam ruangan dan membuangnya ke luar.
c. Pembangkitan Listrik
Pembangkit listrik, baik yang berbahan bakar fosil, nuklir, atau tenaga uap, semuanya menggunakan prinsip termodinamika. Energi panas dihasilkan melalui pembakaran atau reaksi nuklir, kemudian digunakan untuk memanaskan air dan mengubahnya menjadi uap, yang kemudian menggerakkan turbin untuk menghasilkan listrik.
d. Proses Biologis
Tubuh manusia juga mengikuti hukum-hukum termodinamika. Proses metabolisme dalam tubuh kita adalah contoh bagaimana energi kimia dari makanan diubah menjadi energi mekanik atau panas untuk menjaga tubuh tetap berfungsi.
—
6. Kesimpulan
Termodinamika adalah ilmu yang mempelajari bagaimana energi berpindah, berubah bentuk, dan berinteraksi dengan materi. Dengan empat hukum dasar yang mengatur hubungan antara energi, kerja, dan kalor, termodinamika membantu kita memahami berbagai fenomena dari mesin hingga proses biologis.
Melalui perumpamaan sederhana seperti uang yang masuk dan keluar dari dompet, orang-orang yang menari di pesta, atau kamar yang semakin berantakan, kita bisa lebih mudah memahami konsep-konsep dasar dalam termodinamika. Hukum-hukum ini tidak hanya relevan dalam fisika, tetapi juga memiliki aplikasi yang luas dalam teknologi dan kehidupan sehari-hari.
Termodinamika mengajarkan kita bahwa energi adalah hal yang fundamental dalam alam semesta, dan bahwa semua proses alami terikat pada prinsip-prinsip kekekalan dan ketidakteraturan.
