Data Relevan:
- Hukum Termodinamika:
- Hukum Pertama Termodinamika: Menggambarkan prinsip kekekalan energi, bahwa energi dalam suatu sistem tidak dapat diciptakan atau dimusnahkan, tetapi hanya dapat berubah bentuk.
- Hukum Kedua Termodinamika: Menyatakan bahwa entropi suatu sistem cenderung meningkat seiring waktu, dan tidak mungkin ada proses yang sepenuhnya efisiensi.
- Hukum Ketiga Termodinamika: Berhubungan dengan sifat absolut nol dan menyatakan bahwa tidak mungkin mencapai suhu mutlak nol dalam jumlah langkah terhingga.
- Sistem dan Lingkungan:
- Sistem: Area yang diteliti dalam termodinamika, seperti benda atau zat tertentu yang mengalami perubahan energi.
- Lingkungan: Area di luar sistem yang berinteraksi dengan sistem dan dapat mempengaruhi perubahan energi.
- Proses Termodinamika:
- Proses Isoterma: Proses di mana suhu sistem tetap konstan selama perubahan energi.
- Proses Isokorik: Proses di mana volume sistem tetap konstan selama perubahan energi.
- Proses Isobarik: Proses di mana tekanan sistem tetap konstan selama perubahan energi.
Penjelasan:
Termodinamika adalah cabang ilmu fisika yang mempelajari perubahan energi dalam sistem dan hubungannya dengan panas, kerja, dan suhu. Hukum pertama termodinamika menyatakan bahwa energi dalam suatu sistem tidak dapat diciptakan atau dimusnahkan, melainkan hanya dapat berubah bentuk. Ini berarti bahwa energi yang masuk ke dalam sistem harus sama dengan energi yang keluar dari sistem.
Hukum kedua termodinamika menyatakan bahwa entropi, yang menggambarkan tingkat ketidaturan dalam sistem, cenderung meningkat seiring waktu. Ini berarti bahwa ada batasan atas untuk efisiensi suatu proses, dan tidak mungkin ada proses yang sepenuhnya efisiensi. Misalnya, dalam mesin termal, tidak mungkin mengubah seluruh panas menjadi kerja, selalu ada kerugian panas yang dihasilkan.
Hukum ketiga termodinamika berhubungan dengan sifat absolut nol, yaitu suhu terendah yang dapat dicapai. Hukum ini menyatakan bahwa tidak mungkin mencapai suhu mutlak nol dalam jumlah langkah terhingga. Suhu mutlak nol adalah -273,15 derajat Celsius.
Dalam termodinamika, sistem dan lingkungan berperan penting. Sistem adalah area yang diteliti, seperti benda atau zat tertentu yang mengalami perubahan energi. Lingkungan adalah area di luar sistem yang berinteraksi dengan sistem dan dapat mempengaruhi perubahan energi dalam sistem.
Proses termodinamika menggambarkan bagaimana energi berubah dalam sistem. Proses isoterma adalah proses di mana suhu sistem tetap konstan selama perubahan energi. Proses isokorik adalah proses di mana volume sistem tetap konstan, sedangkan proses isobarik adalah proses di mana tekanan sistem tetap konstan.
Termodinamika memiliki aplikasi yang luas dalam berbagai bidang, seperti mesin, kimia, dan teknik. Konsep-konsep dalam termodinamika digunakan untuk merancang sistem yang efisien, mengoptimalkan penggunaan energi, dan memahami perubahan energi dalam proses fisika dan kimia.
Sumber Daya:
- “Introduction to Thermodynamics and Heat Transfer” oleh Yunus A. ÇengResources:
- “Introduction to Thermodynamics and Heat Transfer” by Yunus A. Çengel
- “Thermodynamics: An Engineering Approach” by Cengel and Boles
- “Principles of Thermodynamics” by Frank Muller
- “Thermodynamics and Its Applications” by Jefferson W. Tester, Michael Modell, and William B. Orr
Termodinamika adalah cabang ilmu fisika yang mempelajari perubahan energi dalam sistem dan hubungannya dengan panas, kerja, dan suhu. Termodinamika menggambarkan bagaimana energi dapat berpindah dari satu bentuk ke bentuk lainnya, serta bagaimana energi tersebut dapat digunakan untuk melakukan kerja atau menghasilkan panas. Konsep-konsep dalam termodinamika digunakan dalam berbagai bidang, seperti mesin, kimia, dan teknik.
Energi hanya dapat ditukar dari satu sistem ke sistem lainnya dalam bentuk panas atau kerja.
Apa itu Termodinamika?
Termodinamika (dari bahasa Yunani termos , “panas” dan dinamo , “kekuatan, gaya”) disebut sebagai cabang fisika yang mempelajari aksi mekanis panas dan bentuk energi serupa lainnya. Kajiannya mendekati objek sebagai sistem makroskopis nyata, melalui metode ilmiah dan penalaran deduktif, dengan memperhatikan variabel luas seperti entropi, energi internal atau volume; serta variabel non-ekstensif seperti suhu, tekanan atau potensi kimia, di antara jenis besaran lainnya.
Namun, termodinamika tidak memberikan interpretasi terhadap besaran yang dipelajarinya, dan objek kajiannya selalu berupa sistem yang berada dalam keadaan setimbang, yaitu sistem yang karakteristiknya dapat ditentukan oleh elemen internal dan bukan oleh gaya eksternal yang bekerja padanya.. Oleh karena itu, energi dianggap hanya dapat ditukar dari satu sistem ke sistem lainnya dalam bentuk panas atau kerja.
Studi formal termodinamika dimulai berkat Otto von Guericke pada tahun 1650, seorang fisikawan dan ahli hukum Jerman yang merancang dan membangun pompa vakum pertama, menyangkal Aristoteles dan pepatahnya bahwa “alam membenci ruang hampa” dengan penerapannya. Setelah penemuan ini, ilmuwan Robert Boyle dan Robert Hooke menyempurnakan sistem mereka dan mengamati korelasi antara tekanan, suhu, dan volume. Maka lahirlah prinsip termodinamika.
Lihat juga: Panas spesifik
sistem termodinamika
Sistem termodinamika dipahami sebagai bagian dari alam semesta yang, untuk tujuan studi, secara konseptual diisolasi dari yang lain dan diusahakan untuk dipahami secara mandiri. Catat cara-cara energi berubah atau dipertahankan dan, pada saat yang sama, pertukaran materi dan/atau energi dengan lingkungan atau dengan sistem serupa lainnya (jika ada). Oleh karena itu, ini adalah metode mempelajari termodinamika.
Kriteria klasifikasi utama sistem ini didasarkan pada tingkat isolasi dari lingkungan, sehingga membedakan antara:
- Sistem terbuka. Sistem yang secara bebas bertukar energi dan materi dengan lingkungannya, seperti yang dilakukan sebagian besar sistem yang dikenal dalam kehidupan sehari-hari. Misalnya: mobil. Anda memberinya bahan bakar dan ia mengembalikan gas dan panas ke lingkungan.
- Sistem tertutup. Mereka yang bertukar energi dengan lingkungannya, tapi bukan materi. Hal ini terjadi pada wadah tertutup, seperti kaleng, yang isinya tidak berubah, namun lama kelamaan kehilangan panas dan membuangnya ke udara sekitar.
- Sistem terisolasi. Yang, sampai batas tertentu, tidak bertukar energi atau materi dengan lingkungan. Tentu saja, tidak ada sistem yang terisolasi sempurna, tetapi ada pada tingkat tertentu: termos yang berisi air panas akan mempertahankan suhunya untuk sementara waktu, cukup untuk tetap terisolasi untuk sementara waktu.
Hukum termodinamika
Termodinamika diatur oleh apa yang ditetapkan dalam empat prinsip atau hukum fundamentalnya, yang dirumuskan oleh berbagai ilmuwan sepanjang sejarah disiplin ini. Prinsip atau hukum tersebut adalah:
- Prinsip pertama, atau Hukum Kekekalan energi. Hal ini menetapkan bahwa jumlah total energi dalam sistem fisik apa pun yang terisolasi dari lingkungannya akan selalu sama, meskipun energi tersebut dapat diubah dari satu bentuk energi ke berbagai bentuk energi lainnya. Singkatnya: “Energi tidak dapat diciptakan atau dimusnahkan, hanya dapat diubah.”
- Prinsip ketiga, atau Hukum nol mutlak. Hal ini menyatakan bahwa entropi suatu sistem yang dianggap nol mutlak akan selalu merupakan konstanta tertentu. Artinya, setelah mencapai nol mutlak (-273,15° C atau 0 K), proses sistem fisik berhenti dan entropi memiliki nilai minimum yang konstan.
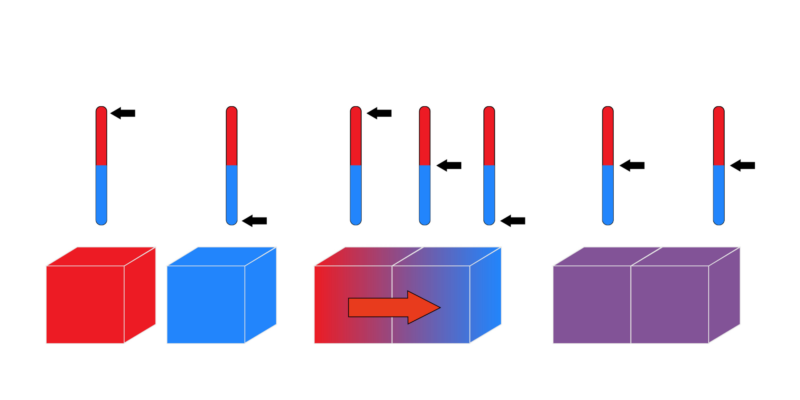
- Prinsip nol atau Hukum kesetimbangan termal. Disebut “hukum nol” karena meskipun merupakan hukum terakhir yang didalilkan, namun sila-sila dasar dan mendasar yang ditetapkannya memiliki prioritas di atas ketiga undang-undang lainnya. Prinsip ini menyatakan bahwa “jika dua sistem berada dalam kesetimbangan termal secara independen dengan sistem ketiga, maka keduanya juga harus berada dalam kesetimbangan termal satu sama lain.”
Lebih lanjut di: Hukum termodinamika
Termodinamika kimia
Termodinamika kimia adalah bidang studi terpisah, yang berfokus pada korelasi antara panas dan kerja, serta reaksi kimia, semuanya dibingkai dalam prinsip termodinamika. Artinya, penerapan hukum termodinamika, khususnya dua hukum pertama, pada dunia reaksi antara zat dan senyawa, menghasilkan apa yang disebut “persamaan fundamental Gibbs”, yang mengatur bagaimana energi kimia terkandung. dalam berbagai senyawa berubah dan ditransmisikan, atau bagaimana derajat entropi alam semesta meningkat setiap kali terjadi reaksi spontan.
Referensi
- “Termodinamika” di Wikipedia.
- “Hukum termodinamika dalam 5 menit” (video) di Fraktur Kuantum.
- “Apa itu termodinamika?” di LAB Fisika.
- “Konsep dasar termodinamika” di Universitas Basque Country.
- “Termodinamika: Kursus Singkat dalam Fisika” (video) di Kursus Singkat.
- “Termodinamika” dalam The Encyclopaedia Britannica.
Pertanyaan Umum tentang Termodinamika
1. Apa itu termodinamika?
Termodinamika adalah cabang ilmu fisika yang mempelajari perubahan energi, panas, dan kerja dalam sistem fisik. Termodinamika juga mempelajari tentang hubungan antara energi dan entropi, serta prinsip-prinsip yang mengatur perubahan energi dalam sistem tertutup.
2. Apa yang dimaksud dengan sistem dalam termodinamika?
Dalam termodinamika, sistem merujuk pada bagian tertentu dari dunia fisik yang kita amati atau analisis. Sistem dapat berupa benda tunggal, seperti alat pemanas, atau kombinasi dari beberapa benda yang berinteraksi, seperti mesin uap. Sistem juga dapat dibatasi oleh batas tertentu atau dapat berinteraksi dengan lingkungannya.
3. Apa itu hukum termodinamika?
Hukum termodinamika adalah prinsip-prinsip dasar yang mengatur perubahan energi dalam sistem fisik. Ada tiga hukum termodinamika yang paling penting:
- Hukum Pertama Termodinamika: Prinsip kekekalan energi, yang menyatakan bahwa energi tidak dapat diciptakan atau dihancurkan, tetapi hanya dapat berubah bentuk atau dipindahkan dari satu bentuk ke bentuk lain.
- Hukum Kedua Termodinamika: Prinsip entropi, yang menyatakan bahwa entropi alami dalam sistem tertutup selalu meningkat atau setidaknya konstan.
- Hukum Ketiga Termodinamika: Menyatakan bahwa saat suhu mendekati nol mutlak, entropi pendekatan nol dan tidak ada lagi perubahan yang terjadi.
4. Apa peran termodinamika dalam kehidupan sehari-hari?
Termodinamika memiliki peran penting dalam banyak aspek kehidupan sehari-hari, termasuk:
- Sistem pemanas dan pendingin rumah: Prinsip-prinsip termodinamika digunakan dalam desain dan pengoperasian sistem pemanas dan pendingin untuk mencapai efisiensi dan kenyamanan yang optimal.
- Mesin dan kendaraan: Termodinamika adalah dasar dari desain dan pengoperasian mesin, termasuk mesin mobil, pesawat, dan generator listrik.
- Energi dan lingkungan: Termodinamika membantu dalam pemahaman dan pengelolaan sumber daya energi, termasuk pembangkit listrik tenaga panas bumi, panel surya, dan turbin angin. Selain itu, termodinamika juga memainkan peran dalam pemahaman dan mitigasi perubahan iklim.
- Biologi dan kesehatan: Termodinamika memainkan peran dalam pemahaman proses metabolisme, pernapasan, dan termoregulasi dalam organisme hidup.
5. Apa yang dimaksud dengan entropi dalam termodinamika?
Entropi adalah ukuran ketidaktersusunan atau kekacauan dalam sistem. Dalam termodinamika, entropi digunakan untuk menjelaskan perubahan energi dalam sistem dan menggambarkan arah perubahan yang terjadi. Secara umum, entropi meningkat ketika energi disebar dengan lebih merata atau ketika sistem mengalami kekacauan yang lebih besar.
Pertanyaan Umum tentang Prinsip Termodinamika
1. Apa yang dimaksud dengan perubahan energi dalam sistem termodinamika?
Perubahan energi dalam sistem termodinamika merujuk pada perubahan dalam bentuk energi yang terjadi dalam sistem tersebut. Ini bisa berupa perubahan energi kinetik, energi potensial, energi internal, atau perubahan energi panas yang ditransfer ke atau dari sistem.


