Ketika kita belajar tentang kimia dan fisika materi, ada dua istilah yang sering muncul terkait dengan sifat-sifat zat padat, yaitu alotrop dan polimorf. Kedua istilah ini memang terdengar agak teknis, tetapi kalau kita uraikan dengan sederhana, sebenarnya perbedaannya cukup jelas dan menarik untuk dipahami. Artikel ini akan membahas perbedaan antara alotrop dan polimorf, serta mengapa keduanya penting dalam memahami bagaimana elemen dan senyawa berperilaku dalam kondisi yang berbeda.
Alotrop: Berbeda Bentuk, Tapi Masih Elemen yang Sama
Alotrop adalah istilah yang digunakan untuk merujuk pada bentuk-bentuk berbeda dari unsur kimia yang sama. Jadi, dalam alotropi, kita berbicara tentang elemen tunggal yang bisa ada dalam beberapa bentuk fisik yang berbeda. Namun, meskipun mereka berbeda dalam hal struktur, mereka tetap terdiri dari elemen yang sama.
Contoh paling terkenal dari fenomena alotrop adalah karbon. Karbon, yang merupakan elemen dengan nomor atom 6, bisa muncul dalam beberapa bentuk yang sangat berbeda, seperti:
- Grafit: Bentuk karbon yang biasa kita temukan dalam pensil. Grafit terdiri dari lapisan-lapisan atom karbon yang tersusun dalam pola heksagonal, di mana lapisan-lapisan ini bisa meluncur satu sama lain, membuatnya licin dan lunak.
- Intan (Berlian): Meskipun terbuat dari karbon, struktur atomnya sangat berbeda dibandingkan grafit. Dalam intan, atom-atom karbon terikat dalam pola tiga dimensi yang sangat kuat, membuatnya menjadi material paling keras di bumi.
- Fullerene: Ini adalah alotrop lain dari karbon yang memiliki struktur mirip bola atau tabung. Fullerene kadang-kadang disebut “buckyball” karena bentuknya yang menyerupai bola sepak.
Semua contoh ini terbuat dari elemen karbon, tetapi dengan struktur atom yang sangat berbeda, sehingga memiliki sifat fisik dan kimia yang juga berbeda drastis. Jadi, meskipun grafit dan intan adalah dua bentuk alotrop karbon, sifatnya bertolak belakang—grafit lunak dan hitam, sementara intan keras dan transparan.
Polimorf: Senyawa yang Sama, Struktur Kristal yang Berbeda
Berbeda dengan alotrop, polimorf mengacu pada fenomena di mana senyawa yang sama dapat mengkristal dalam lebih dari satu bentuk struktur kristal. Dalam hal ini, kita tidak lagi berbicara tentang unsur tunggal, melainkan tentang senyawa kimia, yang mungkin terdiri dari beberapa elemen. Fenomena polimorfisme sering terjadi dalam dunia farmasi, mineral, dan material lainnya, di mana bentuk kristal suatu senyawa dapat mempengaruhi sifat fisik dan kimianya.
Misalnya, senyawa kalsium karbonat (CaCO₃) memiliki dua polimorf utama:
- Kalsit: Salah satu bentuk kristal yang paling umum dari kalsium karbonat. Kalsit biasanya berbentuk kristal rombohedral.
- Aragonit: Ini adalah bentuk kristal lain dari kalsium karbonat, tetapi dalam struktur yang lebih padat dan stabil pada suhu dan tekanan tertentu.
Keduanya terbuat dari molekul yang sama, tetapi susunan atom-atom di dalam kristal mereka berbeda, itulah yang menyebabkan mereka dianggap sebagai polimorf. Dalam banyak kasus, perbedaan struktur ini bisa mempengaruhi sifat fisik seperti kekerasan, titik leleh, atau bagaimana senyawa tersebut larut dalam air.
Perbedaan Utama Alotrop dan Polimorf
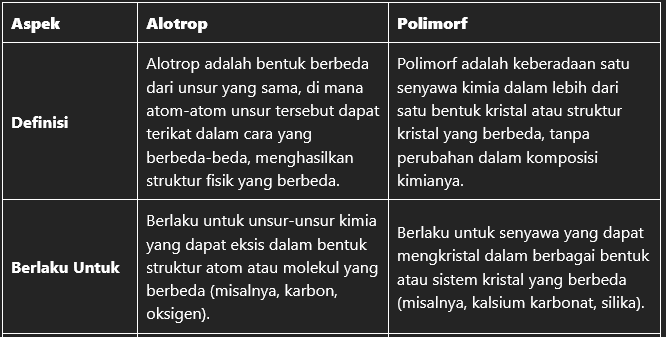
Berikut adalah tabel yang memperlihatkan perbedaan antara Alotrop dan Polimorf:
| Aspek | Alotrop | Polimorf |
| Definisi | Alotrop adalah bentuk berbeda dari unsur yang sama, di mana atom-atom unsur tersebut dapat terikat dalam cara yang berbeda-beda, menghasilkan struktur fisik yang berbeda. | Polimorf adalah keberadaan satu senyawa kimia dalam lebih dari satu bentuk kristal atau struktur kristal yang berbeda, tanpa perubahan dalam komposisi kimianya. |
| Berlaku Untuk | Berlaku untuk unsur-unsur kimia yang dapat eksis dalam bentuk struktur atom atau molekul yang berbeda (misalnya, karbon, oksigen). | Berlaku untuk senyawa yang dapat mengkristal dalam berbagai bentuk atau sistem kristal yang berbeda (misalnya, kalsium karbonat, silika). |
| Contoh Utama | – Karbon: Grafit, intan, fuleren, grafena. – Oksigen: O₂ (oksigen molekuler), O₃ (ozon). – Fosfor: Fosfor putih, fosfor merah, fosfor hitam. |
– Kalsium karbonat (CaCO₃): Kalsit dan aragonit. – Silika (SiO₂): Kuarsa, tridimit, kristobalit. – Sulfida besi (FeS₂): Pirit dan markasit. |
| Struktur Kristal | Alotrop memiliki struktur atom atau molekul yang berbeda, yang dapat berupa kristalin atau amorf, tergantung pada allotrop yang bersangkutan. | Polimorf memiliki struktur kristal yang berbeda walaupun komposisi kimianya tetap sama. Setiap bentuk polimorf memiliki sistem kristal yang unik (misalnya, kubik, tetragonal, ortorombik). |
| Komposisi Kimia | Alotrop dari suatu unsur memiliki komposisi kimia yang sama (atom dari unsur yang sama), tetapi perbedaan struktur atom atau molekul menyebabkan sifat fisik yang berbeda. | Polimorf memiliki komposisi kimia yang sama (yakni terdiri dari senyawa yang sama), tetapi perbedaan dalam pengaturan kristal menyebabkan sifat fisik yang berbeda. |
| Perubahan Fase | Perubahan dari satu allotrop ke allotrop lain biasanya melibatkan perubahan suhu atau tekanan, seperti karbon berubah dari grafit menjadi intan di bawah tekanan tinggi. | Polimorfisme dapat terjadi melalui perubahan kondisi fisik seperti suhu dan tekanan, yang menyebabkan bentuk kristal berbeda terbentuk (misalnya, kalsit berubah menjadi aragonit pada tekanan tinggi). |
| Sifat Fisik | Alotrop dapat memiliki sifat fisik yang sangat berbeda, seperti kekerasan, warna, konduktivitas, dan titik leleh. Contohnya, grafit adalah konduktor listrik dan lunak, sementara intan adalah isolator dan sangat keras. | Polimorf dapat memiliki sifat fisik yang berbeda seperti bentuk kristal, kerapatan, titik leleh, dan stabilitas termal, tetapi tidak seberbeda allotrop. Misalnya, polimorf kalsium karbonat (kalsit dan aragonit) memiliki kerapatan dan stabilitas yang berbeda. |
| Contoh dalam Kehidupan Sehari-hari | – Karbon: Intan digunakan dalam perhiasan dan alat pemotong, sementara grafit digunakan dalam pensil dan sebagai pelumas. – Oksigen: O₂ adalah oksigen yang kita hirup, sementara O₃ adalah ozon yang melindungi kita dari radiasi ultraviolet. |
– Kalsium karbonat: Kalsit ditemukan dalam batu kapur dan marmer, sementara aragonit ditemukan dalam struktur kerang. – Silika (SiO₂): Kuarsa digunakan dalam pembuatan kaca, sedangkan tridimit dan kristobalit terbentuk pada suhu tinggi dalam bahan keramik. |
| Stabilitas Termal | Setiap allotrop memiliki stabilitas termal yang berbeda. Misalnya, intan lebih stabil pada tekanan tinggi, sedangkan grafit lebih stabil pada tekanan rendah. | Setiap polimorf memiliki stabilitas termal yang berbeda, di mana satu bentuk polimorf mungkin lebih stabil pada suhu rendah, sedangkan yang lain lebih stabil pada suhu tinggi. |
| Proses Pembentukan | Alotrop terbentuk karena perbedaan kondisi pembentukan di alam, seperti tekanan, suhu, dan lingkungan kimia yang berbeda. Misalnya, intan terbentuk pada tekanan tinggi, sementara grafit terbentuk pada kondisi yang lebih rendah. | Polimorf terbentuk karena perbedaan dalam kondisi kristalisasi, seperti perubahan suhu, tekanan, atau pelarut yang digunakan selama proses kristalisasi. |
| Konsekuensi Industri | Alotrop unsur tertentu, seperti intan dan grafit, memiliki nilai ekonomi yang sangat berbeda karena sifat fisiknya. Intan sangat berharga karena kekerasannya, sementara grafit digunakan dalam aplikasi seperti pelumas dan elektroda. | Polimorfisme penting dalam industri farmasi, karena polimorf yang berbeda dari suatu obat dapat memiliki bioavailabilitas, kelarutan, dan stabilitas yang berbeda, yang memengaruhi efektivitas obat. |
| Relevansi Kimia | Alotrop adalah fenomena yang berkaitan erat dengan kimia unsur, terutama unsur-unsur yang memiliki kemampuan untuk mengatur ulang struktur atomnya, seperti karbon, oksigen, dan fosfor. | Polimorfisme lebih relevan dalam kimia senyawa, terutama dalam kristalografi dan ilmu material, di mana perbedaan dalam bentuk kristal dapat memengaruhi sifat material. |
Ringkasan:
- Alotrop: Merupakan bentuk yang berbeda dari unsur yang sama, di mana atom-atom unsur tersebut diatur dengan cara yang berbeda. Contoh yang terkenal adalah karbon yang memiliki allotrop berupa grafit dan intan.
- Polimorf: Merupakan bentuk yang berbeda dari senyawa yang sama, di mana molekul-molekul senyawa tersebut diatur dalam bentuk kristal yang berbeda. Contoh yang sering disebut adalah kalsit dan aragonit, dua polimorf dari kalsium karbonat (CaCO₃).
Tabel ini memberikan perbandingan detail antara alotrop dan polimorf, termasuk perbedaan struktur, contoh-contoh, serta relevansi dalam ilmu kimia dan industri.
Jadi, apa perbedaan paling jelas antara alotrop dan polimorf? Sederhananya, alotrop adalah tentang elemen yang sama dalam berbagai bentuk struktural, sementara polimorf adalah tentang senyawa yang sama tetapi dapat mengkristal dalam lebih dari satu bentuk struktur kristal.
Berikut adalah beberapa poin utama untuk menjelaskan perbedaannya:
- Alotrop adalah elemen, polimorf adalah senyawa. Alotrop hanya terjadi pada elemen kimia tunggal, seperti karbon, oksigen, atau sulfur, yang dapat ada dalam berbagai bentuk. Di sisi lain, polimorf adalah istilah yang digunakan ketika sebuah senyawa seperti kalsium karbonat atau sulfur dioksida mengkristal dalam beberapa bentuk berbeda.
- Perbedaan dalam ikatan atom atau molekul. Dalam alotrop, bentuk yang berbeda muncul karena perubahan dalam ikatan antar atom elemen. Misalnya, dalam intan, atom karbon diikat dalam struktur yang berbeda dari grafit, meskipun keduanya hanya terdiri dari karbon. Polimorf, di sisi lain, terjadi karena perbedaan dalam pengaturan molekul dalam jaringan kristal, meskipun komposisi kimianya tetap sama.
- Sifat fisik dan kimia yang berubah. Baik alotrop maupun polimorf mempengaruhi sifat fisik dan kimia suatu bahan. Namun, perubahannya berbeda. Sebagai contoh, intan sangat keras, sedangkan grafit lunak meskipun keduanya merupakan alotrop karbon. Dalam polimorfisme, senyawa yang sama mungkin memiliki perbedaan dalam titik leleh, kelarutan, atau kekuatan mekanik hanya karena perubahan dalam struktur kristalnya.
- Contoh unsur vs senyawa. Alotropi biasanya ditemukan pada unsur-unsur seperti karbon, oksigen (O₂ sebagai oksigen biasa dan O₃ sebagai ozon), atau fosfor (fosfor putih dan fosfor merah). Polimorfisme, di sisi lain, lebih sering ditemukan pada senyawa kimia seperti kalsium karbonat, sulfur dioksida, atau bahkan obat-obatan.
Mengapa Alotrop dan Polimorf Penting?
Mungkin Anda bertanya-tanya, kenapa kita harus repot-repot memahami alotrop dan polimorf? Apa dampaknya bagi kehidupan sehari-hari?
- Dalam kehidupan sehari-hari, contoh alotrop yang paling nyata adalah oksigen. Kita menghirup O₂ setiap saat untuk bertahan hidup, tetapi bentuk lain dari oksigen, ozon (O₃), sangat beracun jika terhirup dalam jumlah banyak. Namun, ozon juga penting untuk menyerap radiasi ultraviolet di lapisan ozon di atmosfer. Jadi, meskipun kedua bentuk ini hanya berbeda dalam jumlah atom oksigen, fungsinya sangat berbeda.
- Dalam industri farmasi, polimorfisme sangat penting. Beberapa obat-obatan dapat muncul dalam beberapa bentuk polimorf, dan polimorf yang berbeda dapat mempengaruhi efektivitas, stabilitas, dan cara obat tersebut diserap tubuh. Misalnya, sebuah obat dengan satu polimorf mungkin larut dengan cepat dan memberikan efek yang lebih cepat, sementara polimorf lain dari obat yang sama mungkin lebih stabil dan tahan lebih lama.
- Dalam geologi, polimorf juga sangat berpengaruh. Mineral sering kali memiliki beberapa bentuk polimorf, yang dapat mempengaruhi cara mineral tersebut terbentuk dan bagaimana mereka berinteraksi dengan lingkungan. Misalnya, grafit dan intan adalah dua polimorf dari karbon yang sangat berbeda dalam hal kekerasan dan kegunaan.
Kesimpulan
Jadi, perbedaan antara alotrop dan polimorf terletak pada elemen dan senyawa yang terlibat. Alotrop adalah bentuk berbeda dari unsur kimia tunggal, di mana struktur ikatan atomnya berubah. Di sisi lain, polimorf terjadi ketika senyawa kimia yang sama dapat mengkristal dalam bentuk struktur yang berbeda.
Meskipun keduanya terdengar seperti konsep yang rumit, mereka memainkan peran yang sangat penting dalam berbagai aspek kehidupan, mulai dari material yang kita gunakan sehari-hari hingga obat-obatan yang kita konsumsi. Dengan memahami perbedaan ini, kita jadi lebih paham bagaimana dunia kimia bekerja di sekitar kita!
