Kamu mungkin sering mendengar istilah “asam” di kehidupan sehari-hari, entah itu dari pelajaran kimia, makanan asam seperti lemon, atau bahkan produk pembersih rumah tangga. Namun, tahukah kamu bahwa tidak semua asam diciptakan sama? Dalam dunia kimia, ada yang disebut asam kuat dan asam lemah, dan keduanya memiliki perbedaan besar dalam cara mereka berinteraksi dengan lingkungan sekitar mereka. Dalam artikel ini, kita akan membahas secara santai apa itu asam kuat, asam lemah, dan perbedaan utama di antara keduanya.
Apa Itu Asam?
Sebelum kita lebih jauh membahas tentang perbedaan asam kuat dan asam lemah, mari kita mulai dengan dasar-dasarnya. Apa itu asam?
Asam adalah zat yang dapat melepaskan ion hidrogen (H⁺) ketika dilarutkan dalam air. Ketika kamu mencampurkan asam dengan air, molekul-molekul asam akan terpecah menjadi ion-ion, dan inilah yang memberikan sifat asam pada larutan tersebut. Asam juga biasanya memiliki rasa asam (pikirkan lemon atau cuka), bisa mengubah kertas lakmus biru menjadi merah, dan dapat bereaksi dengan basa untuk membentuk garam.
Contoh sederhana dari asam dalam kehidupan sehari-hari adalah cuka (yang mengandung asam asetat), jus lemon (asam sitrat), dan bahkan perutmu memproduksi asam klorida (HCl) untuk membantu pencernaan. Namun, tidak semua asam bersifat sama. Di sinilah perbedaan antara asam kuat dan asam lemah mulai terlihat.
Apa Itu Asam Kuat?
Asam kuat adalah jenis asam yang sepenuhnya terionisasi atau terdisosiasi dalam air. Dengan kata lain, ketika asam kuat dilarutkan dalam air, semua molekul asamnya akan “pecah” menjadi ion-ion, terutama ion hidrogen (H⁺) dan ion negatif lainnya. Karena semua molekul terpecah, asam kuat menghasilkan konsentrasi ion hidrogen yang sangat tinggi dalam larutan, yang membuatnya sangat reaktif dan, tentunya, sangat asam.
Contoh asam kuat yang terkenal adalah asam klorida (HCl), asam sulfat (H₂SO₄), dan asam nitrat (HNO₃). Ketika HCl dilarutkan dalam air, semua molekul HCl akan berubah menjadi ion H⁺ dan ion Cl⁻, sehingga membuat larutan tersebut sangat asam dan sangat korosif. Jika kamu pernah melihat produk pembersih yang sangat kuat, seperti pembersih toilet, beberapa di antaranya mengandung asam kuat untuk melarutkan kotoran dan kerak dengan cepat.
Asam kuat juga dikenal karena kemampuannya untuk bereaksi dengan berbagai macam bahan. Karena ion H⁺ yang dihasilkannya sangat banyak, asam kuat bisa dengan cepat menyerang dan merusak berbagai material, seperti logam, kulit, dan jaringan organik. Jadi, asam kuat bukan sesuatu yang bisa kita mainkan sembarangan!
Apa Itu Asam Lemah?
Di sisi lain, ada yang disebut asam lemah. Berbeda dengan asam kuat, asam lemah hanya terionisasi sebagian dalam air. Ini berarti hanya sebagian kecil molekul asam yang “pecah” menjadi ion-ion, sementara sisanya tetap dalam bentuk molekul utuh. Karena itu, larutan asam lemah memiliki konsentrasi ion hidrogen yang jauh lebih rendah dibandingkan asam kuat.
Contoh umum dari asam lemah adalah asam asetat (ditemukan dalam cuka), asam karbonat (ditemukan dalam minuman berkarbonasi), dan asam sitrat (ditemukan dalam buah-buahan seperti lemon). Ketika kamu melarutkan asam asetat dalam air, hanya sebagian molekul asam asetat yang berubah menjadi ion H⁺ dan ion asetat (CH₃COO⁻), sementara sebagian besar tetap dalam bentuk molekul CH₃COOH. Karena hanya sebagian kecil yang terionisasi, asam lemah tidak sekuat asam kuat.
Meskipun tidak sekuat asam kuat, asam lemah tetap bisa bersifat asam dan digunakan dalam berbagai aplikasi sehari-hari. Contohnya, cuka digunakan sebagai pengawet makanan dan bahan pembersih alami karena sifat asamnya yang bisa membunuh bakteri dan jamur, meskipun tidak sekuat pembersih yang mengandung asam kuat.
Perbedaan Utama Antara Asam Kuat dan Asam Lemah
Berikut adalah tabel yang merinci perbedaan antara Asam Kuat dan Asam Lemah:
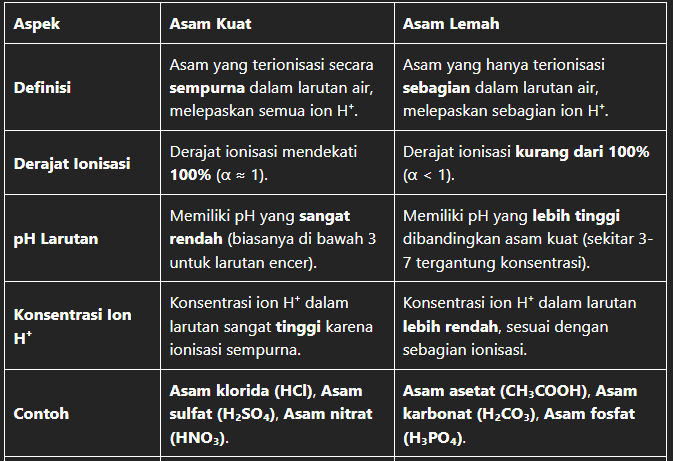
| Aspek | Asam Kuat | Asam Lemah |
|---|---|---|
| Definisi | Asam yang terionisasi secara sempurna dalam larutan air, melepaskan semua ion H⁺. | Asam yang hanya terionisasi sebagian dalam larutan air, melepaskan sebagian ion H⁺. |
| Derajat Ionisasi | Derajat ionisasi mendekati 100% (α ≈ 1). | Derajat ionisasi kurang dari 100% (α < 1). |
| pH Larutan | Memiliki pH yang sangat rendah (biasanya di bawah 3 untuk larutan encer). | Memiliki pH yang lebih tinggi dibandingkan asam kuat (sekitar 3-7 tergantung konsentrasi). |
| Konsentrasi Ion H⁺ | Konsentrasi ion H⁺ dalam larutan sangat tinggi karena ionisasi sempurna. | Konsentrasi ion H⁺ dalam larutan lebih rendah, sesuai dengan sebagian ionisasi. |
| Contoh | Asam klorida (HCl), Asam sulfat (H₂SO₄), Asam nitrat (HNO₃). | Asam asetat (CH₃COOH), Asam karbonat (H₂CO₃), Asam fosfat (H₃PO₄). |
| Konstanta Disosiasi (Ka) | Memiliki nilai Ka yang sangat besar (biasanya lebih dari 1). | Memiliki nilai Ka yang kecil (biasanya jauh lebih kecil dari 1). |
| Reaksi dengan Basa | Bereaksi dengan cepat dan kuat dengan basa, menghasilkan garam dan air. | Bereaksi lebih lambat dan lemah dengan basa, terkadang tidak bereaksi sepenuhnya. |
| Konduktivitas Listrik | Larutan asam kuat memiliki konduktivitas listrik tinggi karena ionisasi sempurna menghasilkan banyak ion. | Larutan asam lemah memiliki konduktivitas listrik yang lebih rendah karena lebih sedikit ion yang dihasilkan. |
| Tingkat Korosi | Lebih korosif dan dapat menyebabkan kerusakan lebih cepat pada bahan-bahan tertentu. | Umumnya kurang korosif dibandingkan asam kuat, tetapi masih bisa bersifat korosif dalam konsentrasi tinggi. |
| Kesetimbangan Kimia | Tidak memiliki kesetimbangan karena terionisasi penuh (reaksi satu arah). | Membentuk kesetimbangan antara molekul asam dan ion yang terionisasi (reaksi dua arah). |
| Pengaruh Terhadap Indikator pH | Mengubah warna indikator pH secara drastis (misalnya, mengubah lakmus biru menjadi merah cerah). | Mengubah warna indikator pH secara lebih moderat dibandingkan asam kuat. |
| Penggunaan | Digunakan dalam industri besar seperti pemurnian logam, produksi pupuk, dan bahan kimia lainnya. | Digunakan dalam aplikasi yang lebih ringan seperti dalam pengawetan makanan (asam asetat), obat-obatan, dan minuman berkarbonasi. |
- Asam Kuat sepenuhnya terionisasi dalam larutan, menghasilkan konsentrasi ion H⁺ yang tinggi dan memiliki sifat yang lebih korosif serta reaktivitas yang lebih tinggi. Contoh yang umum termasuk asam klorida dan asam sulfat.
- Asam Lemah hanya sebagian terionisasi dalam larutan, menghasilkan konsentrasi ion H⁺ yang lebih rendah dan memiliki reaktivitas yang lebih lemah. Contoh asam lemah termasuk asam asetat dan asam karbonat.
Sekarang, setelah kita memahami apa itu asam kuat dan asam lemah, mari kita bahas beberapa perbedaan utama antara keduanya:
- Derajat Ionisasi
Perbedaan paling mendasar antara asam kuat dan asam lemah adalah seberapa banyak molekul asam yang terionisasi di dalam air. Asam kuat terionisasi sepenuhnya, yang berarti semua molekulnya berubah menjadi ion-ion. Sedangkan asam lemah hanya terionisasi sebagian, sehingga tidak semua molekul asamnya berubah menjadi ion. - Konsentrasi Ion Hidrogen (H⁺)
Karena asam kuat terionisasi sepenuhnya, larutan asam kuat akan memiliki konsentrasi ion H⁺ yang sangat tinggi. Ini membuatnya jauh lebih asam dan lebih korosif dibandingkan asam lemah. Sementara itu, asam lemah menghasilkan jauh lebih sedikit ion H⁺, sehingga larutannya cenderung lebih “lembut” dan tidak terlalu reaktif. - Tingkat Keasaman (pH)
Tingkat keasaman suatu larutan diukur dengan skala pH. Asam kuat akan memiliki pH yang sangat rendah, biasanya di bawah 3, karena tingginya konsentrasi ion H⁺. Sebaliknya, asam lemah akan memiliki pH yang sedikit lebih tinggi (meskipun masih di bawah 7, yang netral), karena konsentrasi ion H⁺ yang lebih rendah. Misalnya, larutan HCl mungkin memiliki pH sekitar 1, sementara larutan asam asetat mungkin berada di sekitar pH 4 atau 5. - Reaktivitas
Asam kuat jauh lebih reaktif daripada asam lemah. Karena konsentrasi ion H⁺ yang tinggi, asam kuat dapat bereaksi dengan sangat cepat dan intensif dengan zat-zat lain. Ini sebabnya asam kuat sering digunakan dalam industri untuk melarutkan logam atau membersihkan permukaan yang sangat kotor. Asam lemah, meskipun masih dapat bereaksi, cenderung lebih lambat dan kurang agresif. - Aplikasi dan Penggunaan
Asam kuat dan asam lemah digunakan untuk tujuan yang sangat berbeda. Karena sifatnya yang sangat reaktif, asam kuat sering digunakan dalam proses industri berat, seperti pengolahan logam, pembuatan pupuk, dan bahan pembersih. Misalnya, asam sulfat sering digunakan dalam baterai mobil dan pembuatan bahan kimia lainnya.
Sebaliknya, asam lemah lebih sering digunakan dalam kehidupan sehari-hari. Cuka (asam asetat) digunakan dalam memasak dan sebagai bahan pengawet alami, sementara asam sitrat sering ditemukan dalam minuman dan produk makanan. Asam lemah juga digunakan dalam produk perawatan kulit karena lebih lembut di kulit dibandingkan asam kuat.
Asam Kuat dan Asam Lemah dalam Kehidupan Sehari-hari
Sekarang, mari kita lihat beberapa contoh nyata dari asam kuat dan asam lemah dalam kehidupan sehari-hari.
Contoh Asam Kuat:
- Asam Klorida (HCl): Ditemukan dalam perut kita, HCl membantu pencernaan dengan memecah makanan, tapi dalam bentuk murni, HCl adalah zat yang sangat korosif dan sering digunakan dalam produk pembersih industri.
- Asam Sulfat (H₂SO₄): Digunakan dalam baterai mobil dan proses kimia berat. Asam ini sangat kuat dan sangat reaktif, sehingga harus ditangani dengan sangat hati-hati.
Contoh Asam Lemah:
- Asam Asetat (CH₃COOH): Ini adalah komponen utama dari cuka. Asam asetat sering digunakan dalam pengawetan makanan dan sebagai bahan pembersih alami karena sifat asamnya yang ringan.
- Asam Sitrat: Ditemukan dalam buah-buahan seperti lemon dan jeruk, asam sitrat sering digunakan dalam minuman berkarbonasi, makanan olahan, dan produk kecantikan.
Mengapa Penting Memahami Perbedaan Ini?
Mungkin kamu bertanya, “Kenapa saya perlu tahu perbedaan antara asam kuat dan asam lemah?” Nah, jawabannya cukup sederhana. Memahami perbedaan ini bisa membantu kita lebih berhati-hati dalam menggunakan produk-produk yang mengandung asam. Misalnya, kamu tidak akan mau menggunakan asam kuat seperti HCl untuk membersihkan peralatan dapurmu, karena bisa berbahaya. Di sisi lain, asam lemah seperti cuka atau jus lemon aman digunakan sehari-hari.
Selain itu, pemahaman ini juga penting dalam konteks lingkungan dan kesehatan. Penggunaan asam kuat dalam industri harus diatur dengan ketat karena dampaknya terhadap lingkungan bisa sangat merusak jika tidak ditangani dengan baik.
Kesimpulan
Jadi, perbedaan antara asam kuat dan asam lemah sebenarnya cukup sederhana. Asam kuat terionisasi sepenuhnya dalam air dan menghasilkan lebih banyak ion hidrogen, menjadikannya lebih asam, lebih korosif, dan lebih reaktif. Sebaliknya, asam lemah hanya terionisasi sebagian dan cenderung lebih lembut dan kurang reaktif. Kedua jenis asam ini punya tempatnya masing-masing, baik dalam kehidupan sehari-hari maupun dalam aplikasi industri.
