Mol adalah satuan pengukuran yang digunakan dalam kimia untuk mengukur jumlah zat. Satu mol didefinisikan sebagai jumlah partikel (atom, molekul, atau ion) yang sama dengan jumlah atom dalam 12 gram karbon-12. Konsep mol memungkinkan kita untuk mengukur jumlah zat dalam skala makroskopik yang lebih praktis dan sistematis.

Mol adalah satuan pengukuran yang digunakan dalam kimia untuk mengukur jumlah zat. Satu mol didefinisikan sebagai jumlah partikel (atom, molekul, atau ion) yang sama dengan jumlah atom dalam 12 gram karbon-12. Mol memberikan cara untuk mengukur jumlah zat secara lebih sistematis dalam skala makroskopik. Konsep mol penting dalam kimia karena memungkinkan perbandingan dan perhitungan yang lebih mudah dalam reaksi kimia dan pengukuran kuantitatif.
Untuk menghitung mol kita perlu mengetahui massa atom atau molekul.
Apa itu Mol?
Mol adalah salah satu besaran yang ditetapkan oleh Sistem Satuan Internasional (SI). Simbolnya adalah “mol”.
Mol didefinisikan sebagai jumlah materi yang mengandung sejumlah entitas unsur (atom, molekul, dll.) yang setara dengan jumlah atom dalam 12 gram isotop karbon-12 ( 12 C).
Massa satu mol suatu zat (disebut massa molar) setara dengan massa atom atau molekul (tergantung pada apakah satu mol atom atau molekul dipertimbangkan) yang dinyatakan dalam gram.
Bilangan Avogadro (NA ) adalah jumlah partikel (molekul, atom, elektron) yang terkandung dalam satu mol suatu zat. Ini adalah konstanta yang sesuai dengan nilai 6.022×10^23 mol -1 . Oleh karena itu, 1 mol zat apa pun mengandung 6,022×10^23 entitas dasar zat tersebut. Di sisi lain, bilangan Avogadro memungkinkan konversi dilakukan antara gram dan satuan massa atom, dengan 6,022×10^23 sma (satuan massa atom) sama dengan 1 gram. Bilangan Avogadro adalah jumlah atom yang terkandung dalam 1 mol atom yang massanya sama dengan massa atom suatu unsur.
Lihat juga: Panas spesifik
Bagaimana cara menghitung mol?
Untuk menghitung mol perlu diketahui massa atom atau molekul.
Untuk menghitung mol, perlu diketahui massa atom atau molekul, bergantung pada apakah keduanya merupakan atom atau senyawa. Jadi, untuk menghitung jumlah mol molekul atau atom suatu zat, harus dibuat pecahan antara massa suatu zat terhadap massa molekul atau atomnya. Misalnya, jika kita ingin menghitung jumlah mol X, kita tuliskan:
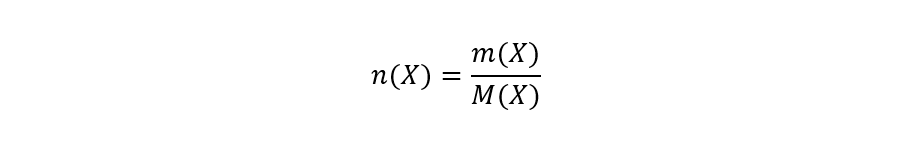
Dimana: adalah jumlah mol X, m(X) adalah massa X dan M(X) adalah massa atom atau molekul X.
Berapa volume satu mol?
Ketika suatu zat berada dalam keadaan gas, volume yang ditempati oleh satu mol dapat dihitung. Volume adalah ukuran besarnya perpanjangan suatu benda dan satuannya adalah meter kubik (m 3 ) dalam SI.
Pada kondisi suhu dan tekanan standar (T=0 ⁰C dan P=1 atm), volume satu mol gas setara dengan 22,4 liter (L). Nilai ini disebut volume molar (Vm) dan sesuai dengan gas ideal. Gas nyata mempunyai nilai Vm yang sedikit berbeda dengan nilai tersebut. Misalnya, CO 2 memiliki Vm=22.3L.
Sejarah Konsep Mol
Konsep mol berkembang dari kebutuhan untuk memiliki satuan standar yang dapat digunakan untuk mengukur jumlah zat dalam kimia. Pada abad ke-19, ilmuwan seperti Amedeo Avogadro dan Johann Josef Loschmidt memainkan peran penting dalam mengembangkan konsep ini. Namun, istilah “mol” sendiri baru diperkenalkan pada awal abad ke-20 oleh Wilhelm Ostwald. Sejak itu, mol menjadi bagian integral dari kimia modern dan digunakan secara luas dalam berbagai bidang ilmu kimia.
Aplikasi Mol dalam Kimia
1. Stoikiometri
Stoikiometri adalah cabang kimia yang mempelajari hubungan kuantitatif antara reaktan dan produk dalam reaksi kimia. Dengan menggunakan mol, kita dapat menghitung jumlah reaktan yang dibutuhkan atau jumlah produk yang dihasilkan dalam suatu reaksi kimia. Contoh sederhana adalah reaksi pembakaran metana ):
CH4+2O2→CO2+2H2O
Dengan menggunakan mol, kita dapat menentukan bahwa satu mol metana bereaksi dengan dua mol oksigen untuk menghasilkan satu mol karbon dioksida dan dua mol air.
2. Konsentrasi Larutan
Dalam kimia larutan, mol digunakan untuk menyatakan konsentrasi zat terlarut. Satuan konsentrasi yang umum digunakan adalah molaritas (M), yang didefinisikan sebagai jumlah mol zat terlarut per liter larutan. Misalnya, larutan 1 M natrium klorida () mengandung satu mol dalam satu liter larutan.
3. Perhitungan Massa Molar
Massa molar adalah massa satu mol suatu zat dan dinyatakan dalam satuan gram per mol (g/mol). Massa molar suatu unsur sama dengan massa atom relatifnya, sementara massa molar senyawa adalah jumlah massa atom relatif dari semua atom dalam molekul tersebut. Misalnya, massa molar air (H2O) adalah 18 g/mol, yang berasal dari penjumlahan massa dua atom hidrogen (1 g/mol masing-masing) dan satu atom oksigen (16 g/mol).
4. Hukum Gas Ideal
Dalam hukum gas ideal, mol digunakan untuk mengukur jumlah gas. Persamaan gas ideal ditulis sebagai:
PV=nRT
Di mana:
- = tekanan gas,
- = volume gas,
- = jumlah mol gas,
- = konstanta gas ideal,
- = suhu dalam Kelvin.
Dengan menggunakan persamaan ini, kita dapat menghitung berbagai sifat gas berdasarkan jumlah mol gas.
Kesimpulan
Mol adalah konsep yang sangat penting dalam kimia, yang memungkinkan para ilmuwan untuk mengukur dan memahami jumlah zat dalam reaksi kimia dengan tepat. Dengan menggunakan mol, kita dapat melakukan perhitungan stoikiometri, menentukan konsentrasi larutan, menghitung massa molar, dan menganalisis perilaku gas. Pemahaman tentang mol dan penggunaannya adalah dasar untuk banyak konsep dan aplikasi dalam kimia modern.
