Dalam termodinamika, proses yang melibatkan perubahan tekanan, volume, dan suhu suatu gas sering diklasifikasikan berdasarkan parameter yang tetap selama proses berlangsung. Dua jenis proses termodinamika yang sering dibahas adalah proses isobarik dan isokhorik.
Perbedaan utama antara keduanya adalah:
- Proses isobarik terjadi pada tekanan tetap, sementara
- Proses isokhorik terjadi pada volume tetap.
Meskipun kedua proses ini merupakan bagian dari hukum gas ideal, efeknya terhadap energi, kerja, dan suhu gas sangat berbeda. Artikel ini akan menjelaskan mekanisme, hukum yang berlaku, serta aplikasi masing-masing proses dalam kehidupan sehari-hari.
Apa Itu Proses Isobarik?
Proses isobarik adalah perubahan keadaan gas yang terjadi pada tekanan konstan, sehingga volume dan suhu dapat berubah selama proses berlangsung.
Karakteristik Proses Isobarik
- Tekanan tetap (P = konstan)
- Volume dan suhu berubah
- Gas melakukan atau menerima kerja (W ≠ 0)
Dalam proses ini, jika suhu gas meningkat, maka volumenya juga akan meningkat sesuai dengan hukum Charles:
![]()
di mana:
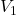 dan
dan 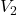 adalah volume awal dan akhir,
adalah volume awal dan akhir,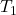 dan
dan 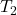 adalah suhu awal dan akhir dalam Kelvin.
adalah suhu awal dan akhir dalam Kelvin.
Cara Kerja Proses Isobarik
1. Jika gas dipanaskan dalam wadah yang dapat mengembang (misalnya silinder dengan piston yang dapat bergerak), suhu meningkat dan volume gas bertambah.
2. Jika gas didinginkan, suhu menurun dan volume gas berkurang.
3. Tekanan tetap dipertahankan, sehingga kerja dilakukan oleh atau pada sistem tergantung pada arah perubahan volume.
Ilustrasi sederhana:
_(Gambar: Diagram menunjukkan gas dalam silinder dengan piston yang bergerak ke atas saat gas dipanaskan dalam proses isobarik)_
Contoh Proses Isobarik dalam Kehidupan Sehari-hari
- Pemanasan gas dalam piston terbuka: Saat gas dipanaskan di dalam silinder mesin, tekanan tetap tetapi volumenya bertambah, sehingga piston bergerak ke atas.
- Mendidihkan air dalam panci terbuka: Saat suhu meningkat, volume uap air bertambah tanpa perubahan tekanan signifikan.
Dalam diagram PV (tekanan-volume), proses isobarik digambarkan sebagai garis horizontal, karena tekanan tetap tetapi volume berubah.
Apa Itu Proses Isokhorik?
Proses isokhorik adalah perubahan keadaan gas yang terjadi pada volume tetap, sehingga hanya tekanan dan suhu yang dapat berubah.
Karakteristik Proses Isokhorik
- Volume tetap (V = konstan)
- Tekanan dan suhu berubah
- Tidak ada kerja yang dilakukan (W = 0)
Dalam proses ini, tekanan gas berubah sesuai dengan hukum Gay-Lussac:
![]()
di mana:
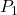 dan
dan 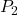 adalah tekanan awal dan akhir,
adalah tekanan awal dan akhir,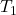 dan
dan 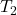 adalah suhu awal dan akhir dalam Kelvin.
adalah suhu awal dan akhir dalam Kelvin.
Cara Kerja Proses Isokhorik
1. Jika gas dipanaskan dalam wadah yang tidak bisa berubah volumenya, maka tekanan meningkat karena molekul gas memiliki energi lebih besar dan bergerak lebih cepat.
2. Jika gas didinginkan, maka tekanan turun karena molekul gas kehilangan energi kinetik.
3. Karena volume tetap, tidak ada perubahan ruang untuk gas, sehingga tidak ada kerja yang dilakukan oleh atau pada sistem.
Ilustrasi sederhana:
_(Gambar: Diagram menunjukkan gas dalam wadah tertutup yang tidak bisa mengembang, sehingga tekanan naik ketika gas dipanaskan dalam proses isokhorik)_
Contoh Proses Isokhorik dalam Kehidupan Sehari-hari
- Kaleng aerosol dalam suhu tinggi: Saat terkena panas, volume gas di dalam kaleng tetap, tetapi tekanannya meningkat, yang bisa menyebabkan kaleng meledak.
- Pemanasan gas dalam tabung tertutup: Dalam reaksi kimia dalam ruang tertutup, peningkatan suhu akan meningkatkan tekanan tanpa mengubah volume.
Dalam diagram PV (tekanan-volume), proses isokhorik digambarkan sebagai garis vertikal, karena volume tetap tetapi tekanan berubah.
Perbedaan Utama Proses Isobarik dan Isokhorik
Setelah memahami mekanisme masing-masing, berikut adalah perbedaan utama antara proses isobarik dan isokhorik:
1. Variabel yang Tetap
- Isobarik: Tekanan tetap, volume dan suhu berubah.
- Isokhorik: Volume tetap, tekanan dan suhu berubah.
2. Perubahan Volume
- Isobarik: Volume bertambah atau berkurang.
- Isokhorik: Volume tetap, tidak ada perubahan ruang gas.
3. Perubahan Tekanan
- Isobarik: Tekanan tetap.
- Isokhorik: Tekanan bertambah atau berkurang sesuai suhu.
4. Pengerjaan Energi (Kerja, W)
- Isobarik: Ada kerja yang dilakukan gas terhadap lingkungan atau sebaliknya.
- Isokhorik: Tidak ada kerja yang dilakukan karena tidak ada perubahan volume.
Ilustrasi sederhana:
_(Gambar: Diagram perbandingan antara proses isobarik dan isokhorik, menunjukkan bagaimana tekanan, volume, dan suhu berubah)_
Kesimpulan
Baik proses isobarik maupun isokhorik merupakan bagian dari prinsip dasar dalam termodinamika yang menjelaskan bagaimana gas berperilaku ketika mengalami perubahan energi.
- Proses isobarik terjadi pada tekanan tetap, di mana volume dan suhu dapat berubah. Contohnya adalah pemuaian gas dalam silinder piston terbuka.
- Proses isokhorik terjadi pada volume tetap, di mana tekanan dan suhu berubah. Contohnya adalah pemanasan gas dalam wadah tertutup seperti kaleng aerosol.
Pemahaman tentang kedua proses ini sangat penting dalam bidang fisika, teknik mesin, dan industri, terutama dalam perancangan mesin pembakaran, sistem pemanas, dan berbagai aplikasi energi.
